时间:2017-01-15 17:39:34
1、填空题 如图所示的甲、乙、丙三种晶体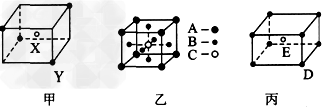
?试推断甲晶体化学式(X为阳离子)为____,乙晶体中A、B、C三种微粒的个数比是
____,丙晶体中每个D微粒周围结合E微粒的个数是________个。
参考答案:X2Y;1:3:1;8
本题解析:
本题难度:一般
2、填空题 (15分)血红素中含有C、O、N、Fe五种元素。回答下列问题:
⑴C、N、O、H四种元素中电负性最小的是?????????????(填元素符合),写出基态Fe原子的核外电子排布式??????????。
⑵下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构式。血红素中N原子的杂化方式有????????????,在右图的方框内用“→”标出Fe2+的配位键。
⑶NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO ________ FeO(填“<”或“>”);
⑷N与H形成的化合物肼(N2H4)可用作火箭燃料,燃烧时发生的反应是: ???
???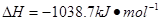
若该反应中有4mol N—H键断裂,则形成的 键有___________mol。
键有___________mol。
⑸根据等电子原理,写出CN—的电子式???????, 1 mol O22+中含有的π键数目为?????。
⑹铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为???,δ、α两种晶胞中铁原子的配位数之比为???。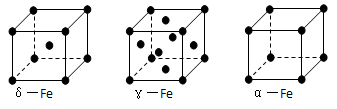
参考答案:⑴H (1分)?? [Ar]3d64S2(2分)
⑵s
本题解析:(1)非金属性越强,电负性越大,故是H。根据构造原理可写出基态Fe原子的核外电子排布式。
(2)根据结构图可看出N原子既有单键还有双键,所以既有sp2杂化,还有sp3杂化。N原子最外层有孤对电子,而亚铁离子有容纳电子的空轨道,所以可形成配位键。
(3)离子晶体中离子键越强,熔沸点越高,形成离子键的微粒半径越小,所带电荷数越多,离子键越强,所以NiO> FeO的。
(4)反应中有4mol N—H键断裂,则生成1.5mol氮气,氮氮三键由2个本题难度:简单
3、选择题 下列说法中正确的是(??)
A.水被冷却到00C以下时变成冰,是因为水分子从液体变成了固体
B.所有物质在温度变化时都能表现出三态变化
C.不降低温度,只增大压强,也可能使物质从气体变成液体
D.物体能够热胀冷缩是因为构成物体的微粒能够热胀冷缩
参考答案:C
本题解析:水分子是不会变化的,选项A不正确;碘加热时可以升华,所以选项B不正确;选项D不正确,应该是微粒之间的距离发生了变化,所以答案选C。
本题难度:简单
4、填空题 (8分)【化学??-物质结构与性质】
利用有关知识回答下列问题:
(1)B、F两元素形成的化合物的空间构型为??????,其中心原子的杂化类型为????????。
(2)CH4与??????(写微粒符号)互为等电子体。
(3)写出元素Cu基态原子的电子排布式???????????????????????。
(4)Fe与CO可形成的Fe(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断该化合物晶体属于??????晶体(填晶体类型)。
(5)Zn的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为???????????。
(6)金属Fe的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示。则面心立方晶胞和体心立方晶胞中实际含有的原子个数之比为?????。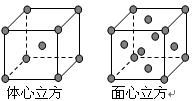
参考答案:
(最后一空2分,其余每空1分)
(1)平面正三
本题解析:略
本题难度:一般
5、选择题 原子间以共价单键相连的非金属单质中,一个原子与相邻原子的成键数为8-N,N为该非金属元素的族序数,化学家把这一现象称为8-N规则.某非金属单质的结构如图所示,则构成该单质的元素位于( )