时间:2017-01-15 17:36:17
1、选择题 已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法不正确的是? [???? ]
A.元素A、B组成的化合物常温下一定呈气态
B.一定条件下,元素C、D的最高价氧化物对应的水化物之间能发生反应
C.工业上常用电解法制备元素C、D、E的单质
D.化合物AE与CE含有相同类型的化学键
参考答案:D
本题解析:
本题难度:一般
2、选择题 有aA、bB、cC、dD四种短周期元素,d-c=c-b=b-a=5,A、B、C最外层电子数总和等于D最外层电子数,下列说法正确的是
A.A、B、C、D四种元素可能都是非金属
B.四种元素中的任意两种形成的化合物分子中,只有两种是非极性分子
C.A、B两元素形成的化合物分子,分子间可能形成氢键
D.C、D两元素形成的化合物是离子晶体
参考答案:D
本题解析:由d-c=c-b=b-a=5,可知:d-a=15,在解本题时要注意是短周期元素且d≥16或a=1的突破口,就容易推出四种元素分别为H、C、Na、S。在B选项中,C和H形成的不只是CH4,也可以形成CH2=CH2、CH3CH3等的非极性分子,C和H形成的化合物分子是不可形成氢键的,故ABC错误。
本题难度:一般
3、填空题 下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用具体的元素符号回答下列问题
(1)④、⑤、⑥的原子半径由大到小的顺序为_________________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_________________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)_________________。
a.MnO2 b.Na2SO3 c.KMnO4
参考答案:(1)Na>Al>O
(2)HNO3>
本题解析:
本题难度:一般
4、选择题 下列元素不属于主族元素的是( )
A.P
B.Ca
C.Fe
D.Cl
参考答案:A、磷来源:91考试网 www.91eXam.org元素在第ⅤA,属于主族元素,故A不符合;
B、钙
本题解析:
本题难度:简单
5、填空题 下表为元素周期表的一部分,表中所列的字母分别代表一种元素。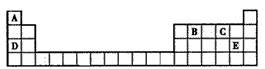
请回答下列问题:
(1)写出A、B的元素符号:A___,B____。
(2)C元素位于周期表中第____周期____族。
(3)元素D、E中原子半径较大的是____(填元素符号)。
(4)写出单质E与水反应的化学方程式____。
参考答案:(1)H; C
(2)二; ⅥA
(3)Na<
本题解析:
本题难度:一般