时间:2017-01-15 17:27:47
1、选择题 下列说法中不正确的是
A.NaCl晶体中离Cl-最近的Na+有6个
B.晶体中有阳离子则一定含有阴离子
C.单晶Si最小环上拥有6个Si原子
D.SiO2晶体的熔点高于SiCl4的熔点
2、选择题 氮化硅是一种超硬、耐磨、耐高温的结构材料。下列各组物质熔化时,与氮化硅熔化所克服的粒子间的作用相同的是
A.硝石(NaNO3)和金刚石
B.晶体硅和水晶
C.重晶石(BaSO4)和萤石(CaF2)
D.冰和干冰
3、填空题 C60以其完美的球形结构受到科学家的高度重视,从此掀起了球形分子的研究热潮。继C60后,科学家又合成了Si60、N60等球形分子。
(1)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体.该物质的K原子和C60分子的个数比为??????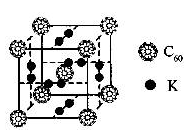
(2)Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为???????
(3)写试出C60、Si60、N60熔点由高到低的顺序为???????????????,破坏这三种分子所需要的能量顺序为???????????????
4、填空题 1)构成分子晶体的粒子是__________,这类粒子间的作用力一定有__________,还可能有__________。如果分子间作用力只是__________,若以一个分子为中心,其周围通常可以有__________个紧邻的分子,分子晶体的这一特征称为__________。干冰中CO2分子采取的就是这样的堆积方式。若分子内存在吸引电子能力较强、半径较小的__________原子与H原子所形成的共价键,则会形成氢键,氢键不仅具有饱和性,也具有__________。能形成氢键的物质较多,如______________________________等。在冰中,每个水分子与相邻的__________个水分子形成氢键,呈__________立体结构。
(2)在原子晶体中,所有原子都以__________键结合,整个原子晶体是一个三维的__________结构。在金刚石中,C原子采取__________杂化方式,每个C原子与另外__________个C原子以共价键相结合,键角为__________,晶体中最小碳环由__________个C原子构成,且不在同一个平面内。晶体硅的结构与金刚石类似,SiO2的晶体结构可以看作是在晶体硅的Si—Si键之间插入__________原子而形成的,在12 g SiO2晶体中含有化学键的物质的量为 __________mol。
5、推断题 下表是元素周期表中短周期的一部分,表中所列字母分别代表一种元素。 
(1)上述元素的单质中熔点最高的是______(填字母); dh4比gh4稳定,其原因是________________ 。
(2)f和a所形成的物质的沸点在f相应主族元素的同类型化合物中比较高,其原因是_________________。
(3)在发射“神舟”七号载人飞船的火箭推进器中,盛有分别由a、e和a、f元素组成的两种液态化合物,它们的分子皆为18电子粒子,当它们混合反应时即产生e的单质和a2f。该反应的化学方程式为___________________________。
(4)f的氢化物属于_______晶体;a与d形成的最简单有机化合物,其分子的空间构型是__________,它的晶体属于______晶体。
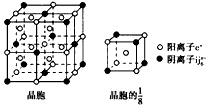
(5)c、i、j可组成离子化合物cxij6,其晶胞结构如下图所示,阳离子c+(用“○”表示)位于正方体棱的中点和正方体内部;阴离子ij6x-(用“●”表示)位于该正方体的顶点和面心。该化合物的化学式是__________。