时间:2017-01-15 17:22:30
1、选择题 下列叙述中正确的是 [???? ]
A.干冰气化时碳氧键发生断裂
B.CaO和SiO2晶体中都不存在单个小分子
C.Na2O与Na2O2所含化学键类型完全相同
D.Br2蒸汽被木炭吸附时共价键被破坏
2、选择题 下列反应过程中,无离子键断裂,但有离子键形成的是 [???? ]
A.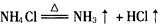
B.NH3+CO2+H2O = NH4HCO3
C.2NaOH+Cl2 = NaCl+ NaClO+H2O
D.2Na2O2+2CO2 = 2Na2CO3+O2
3、选择题 下列叙述正确的是
A.水结成冰体积膨胀、密度变小,这一事实与水中存在氢键有关
B.共价化合物可能含有离子键
C.离子化合物中只含有离子键
D.阴、阳离子之间有强烈的吸引作用而没有排斥作用
4、简答题 原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.
(1)X元素是______(填名称),W在周期表中的位置______.
(2)X与Y?形成化合物的电子式为______,X与W组成的化合物中存在______键(填“离子”“共价”).
(3)写出实验室制备YX3的化学方程式:______
(4)由X、Y、Z、W四种元素组成的一种离子化合物A,已知1mol?A能与足量NaOH浓溶液反应生成标准状况下44.8L气体.则A的名称是______.
(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1mol?B中含有6mol结晶水.对化合物B进行如下实验:
a.?取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体.过一段时间白色沉淀变为灰绿色,最终变为红褐色;b.?另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解则B的化学式为______.
5、选择题 在短周期中的X和Y两种元素可组成化合物XY3,说法正确的是( )
A.X和Y一定不属于同一主族
B.X和Y可属于同一周期,也可属于两个不同周期
C.若Y的原子序数为m,X的原子序数不可能是m±4
D.XY3一定是离子化合物