时间:2017-01-15 17:08:24
1、选择题 99毫升0.1 mol/L盐酸和101毫升0.05 mol/L氢氧化钡溶液相混和后,溶液的pH值为
A.1.7
B.10.7
C.11
D.11.3
参考答案:C
本题解析:考查pH的计算。根据酸和碱的量可知,氢氧化钡是过量的,所以反应后OH-的浓度为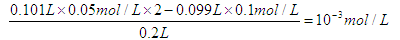 ,所以氢离子浓度是10-11mol/L,即pH等于11。答案选C。
,所以氢离子浓度是10-11mol/L,即pH等于11。答案选C。
本题难度:简单
2、选择题 H+浓度均为0.01mol/L的盐酸和醋酸各100ml分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,有关叙述正确的是 [???? ]
A.醋酸与锌反应放出氢气多
B.盐酸和醋酸分别与锌反应放出的氢气一样多
C.醋酸与锌反应速率大
D.盐酸和醋分别与锌反应的速度一样大
参考答案:BC
本题解析:
本题难度:一般
3、选择题 某物质溶于水中后可得到0.10 mol/L的溶液,该溶液中除水电离出的H+、OH-外不存在其它离子,则该物质可能是
A.乙醇
B.乙酸
C.苯酚
D.苏打
参考答案:A
本题解析:
试题分析:乙醇是非电解质,与水混溶,但是乙醇不能电离出离子,只有水能电离出氢离子和氢氧根离子,故A正确;乙酸是电解质或弱电解质,易溶于水,乙酸能部分电离出乙酸根离子和氢离子,水也能部分电离出氢离子和氢氧根离子,故B错误;苯酚是电解质或弱电解质,常温下可溶于水,苯酚能部分电离出苯酚根离子、氢离子,水也能部分电离出氢离子和氢氧根离子,故C错误;苏打的化学式为Na2CO3,Na2CO3是电解质或强电解质,易溶于水,碳酸钠能完全电离出钠离子、碳酸根离子,水也能部分电离出氢离子和氢氧根离子,故D错误。
本题难度:简单
4、选择题 pH=1的两种一元酸HX与HY溶液,分别取50 mL加入足量的镁粉,充分反应后,收集到H2体积分别为V(HX)和V(HY)。若V(HX)>V(HY),则下列说法正确的是
A.HX可能是强酸
B.HX的酸性比HY的酸性弱
C.两酸的浓度大小[HX]<[HY]
D.pH=1的两种一元酸均稀释100倍,稀释后两溶液的pH均为3
参考答案:B
本题解析:
试题分析:pH=1的两种一元酸HX与HY溶液中氢离子的浓度相等,在溶液体积相等的条件下,与足量镁反应产生的氢气体积是V(HX)>V(HY),这说明HX一定是弱酸,HY可能是强酸或弱酸,所以选项A不正确,B正确;由于弱酸存在电离平衡,则反应前两酸的浓度大小[HX]>[HY],C不正确;弱酸在稀释过程中促进电离,因此pH=1的两种一元酸均稀释100倍,稀释后两溶液的pH≤3,D不正确,答案选B。
考点:考查弱酸的电离平衡、外界条件对电离平衡的影响以及溶液pH计算等
本题难度:一般
5、填空题 氮气与氢气反应生成氨气的平衡常数见下表:
| | N2+3H2 2NH3 2NH3 | |||
| 温度 | 25℃ | 200℃ | 400℃ | 600℃ |
| 平衡常数K | 5×108 | 650 | 0.507 | 0.01 (1)工业上合成氨的温度一般控制在500℃,原因是 。 (2)在2 L密闭容器中加入1 mol氮气和3 mol氢气,进行工业合成氨的模拟实验,若2分钟后,容器内压强为原来的0.8倍,则0到2分钟,氨气的反应速率为________mol/(L·min)。 (3)下列说法能表明该反应达到平衡的是________ A.气体的平均分子量不再变化 B.密闭容器内的压强不再变化 C.v (N2) =" 2" v (NH3) D.气体的密度不再变化 (4)下列措施,既能加快该反应的反应速率,又能增大转化率的是______________ A.使用催化剂 B.缩小容器体积 C.提高反应温度 D.移走NH3 (5)常温下,在氨水中加入一定量的氯化铵晶体,下列说法错误的是______。 A.溶液的pH增大 B.氨水的电离度减小 C.c(OH-)减小 D.c(NH4+)减小 (6)将氨水与盐酸等浓度等体积混合,下列做法能使c(NH4+)与c(Cl-)比值变大的是________ A. 加入固体氯化铵 B.通入少量氯化氢 C. 降低溶液温度 D.加入少量固体氢氧化钠 参考答案:(1)催化剂的活性温度且反应速率较快(2分); 本题解析: 本题难度:困难 |