时间:2017-01-15 16:37:33
1、选择题 室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示。下列说法正确的是(???)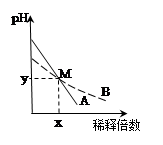
A.稀释前,c(A)> 10 c(B)
B.稀释前,A溶液中由水电离出的OH-的浓度是B溶液中由水电离出的OH-的10倍
C.在M点,A、B两种碱溶液中阳离子的物质的量浓度相等
D.M点时A和B的浓度相等
参考答案:C
本题解析:
试题分析:根据图像可知,稀释相同倍数A的pH相差大,B的pH相差小,所以A是强碱,B是弱碱。如果A、B都是强碱,则pH相差1,c(A)=10c(B),但是B是弱碱不完全电离,所以要电离出相同的OH-,浓度要比强碱大,所以c(A)<10c(B),A项错误;稀释前A的pH比B大于1,所以A溶液中由水电离出的OH-的浓度是B溶液中由水电离出的OH-的0.1倍,B项错误;在M点A、B两溶液的pH相同,所以H+浓度、OH-浓度都相同,根据电荷守恒
本题难度:一般
2、选择题 乙酸的下列性质中,可以证明它是弱电解质的是 ( )
A.乙酸能与水以任意比互溶
B.1 mol/L乙酸溶液的pH值约为2
C.10ml 1mol/L乙酸恰好与10ml 1mol/L NaOH溶液完全反应
D.乙酸溶液酸性很弱
参考答案:B
本题解析:
试题分析:弱电解质的证明,是基于与强电解质对比进行的。弱电解质与强电解质最大的区别就 是弱电解质存在电离平衡,而强电解质不存在电离平衡。因此只要证明有电离平衡存在,就证明了弱电解质。不能利用物质的溶解性来判断是否为弱电解质,即溶解性与电解质的强弱无关,A不正确;1mol/L的乙酸溶液的c(H+)约为0.01 mol?L-1,乙酸的物质的量浓度大于氢离子浓度,说明乙酸不完全电离,为弱电解质,故B正确;10mL1mol/L酸恰好与10mL1mol/LNaOH溶液完全反应,只能说明乙酸为一元酸,不能说明其电离的程度,故C错误;溶液的酸性强弱,取决于溶液中氢离子的浓度,乙酸溶液酸性很弱,但不能证明乙酸存在电离平衡,故D错误,答案选B。
考点:考查弱电解质的判断方法
点评:该题是中等难度的试题,试题贴近高考,基础性强,有利于培养学生的逻辑思维能力和抽象思维能力。明确弱电解质在水中电离不完全是解答本题的关键。该题的易错点是选项D。
本题难度:一般
3、选择题 下列选项中所涉及到的两个量一定相等的是[???? ]
A.质量相等、体积不等的N2和C2H4的分子数
B.18.0?g重水(D2O)与20?g?Ne所含有的电子数
C.等物质的量的Al分别与一定量的盐酸、NaOH溶液反应转移的电子数
D.100?mL?2.0?mol/L盐酸与100?mL?2.0?mol/L醋酸溶液中所含有的H+数
参考答案:A
本题解析:
本题难度:简单
4、选择题 在HAc H++Ac-的电离平衡中,要使电离平衡向左移动,应采取的措施是(???)
H++Ac-的电离平衡中,要使电离平衡向左移动,应采取的措施是(???)
A.加HAc
B.加NaAc
C.加水
D.加NaOH
参考答案:B
本题解析:略
本题难度:简单
5、简答题 要使饱和H2S溶液pH增大的同时,[S2─]减小,可向溶液中加入适量?①NaOH溶液;②水;③SO2;④CuSO4固体;⑤盐酸( )
A.①③⑤
B.②④⑤
C.②③
D.③④⑤
参考答案:由题意知,氢离子浓度减小,硫离子浓度减小,H2S?H++HS
本题解析:
本题难度:一般