时间:2017-01-15 16:11:15
1、计算题 ?钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。 ????
完成下列计算:
(1)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生
40.32?L(标准状况下)氮气,至少需要叠氮化钠______g。
(2)钠-钾合金可在核反应堆中用作热交换液。5.05?g钠-钾合金溶于200?mL水生成0.075?mol氢气。???
①计算溶液中氢氧根离子的物质的量浓度(忽略溶液体积变化)。???
②计算并确定该钠-钾合金的化学式。
(3)氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液。向该溶液中通入二氧化碳,有下列反应:2NaAl(OH)4+CO2→2Al(OH)3↓?+Na2CO3+H2O ??
己知通入二氧化碳336?L(标准状况下),生成24?mol?Al(OH)3和15?mol?Na2CO3,若通入溶液的二氧化碳为112L(标准状况下),计算生成的Al(OH)3和Na2CO3的物质的量之比。
(4)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失。 
上述实验①②③所用氢氧化钠均不含杂质,且实验数据可靠。通过计算,分析和比较上表3组数据,给出结论。
2、选择题 在100mL某混合溶液中,c(HNO3)=0.4?mo/lL、c(H2SO4)=0.1?mol/L,向其中加入1.92gCu粉,微热充分反应后溶液中的c(Cu2+)为 [???? ]
A.0.15mol/L??????
B.0.225mo1/L????
C.0.3mo1/L?????
D.无法计算
3、选择题 将25. 6g Cu与含0.4mol H2SO4的浓硫酸充分反应后,消耗了0.2mol 的H2SO4(气体全部逸出),然后再加入0.1 L 2 mol/LKNO3,充分反应后产生NO物质的量为[???? ]
A.0.05mol
B.0.1mol
C.0.15mol
D.0.2mol
4、填空题 一定量的氢气在氯气中燃烧,所得混合物用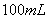
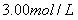 的
的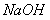 溶液恰好完全吸收,测得溶液中含有的
溶液恰好完全吸收,测得溶液中含有的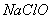 物质的量为
物质的量为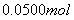 。
。
(1)写出氯气与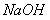 溶液反应的化学方程式:________________________________________ 。
溶液反应的化学方程式:________________________________________ 。
(2)所得溶液中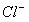 的物质的量为________________ mol。
的物质的量为________________ mol。
(3)所用氯气和参加反应的氢气的物质的量之比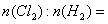 __________________ 。
__________________ 。
5、计算题 元素R的气态氢化物化学式为HxR.在标准状况下,8.5gHxR气体的体积是5.6L。将5.1gHxR气体通入200ml 0.75mol/L的CuCl2溶液中正好完全反应,并生成黑色沉淀.
(1)求HxR的相对分子质量;
(2)推断x值,并确定R元素的名称。