时间:2017-01-15 15:58:07
1、填空题 下表为长式周期表的一部分,其中的编号代表对应的元素。 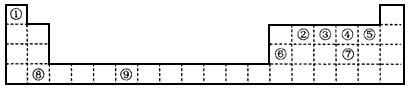
(1)写出上表中元素⑨原子基态时的电子排布式________,该元素的符号是_________。
(2)在元素②与①形成的气态化合物(水果催熟剂)中,元素②的杂化方式为________杂化,分子中σ键与π键之比为____。
(3)①~⑨元素的p亚层有两个单电子且第一电离能最大的元素名称是__________。 ②与④两种元素形成的化合物中,属于非极性分子的是__________(填化学式)。元素④与元素⑦形成的氢化物中,沸点由高到低的顺序为_____________(填化学式)。
(4)解释工业上制取⑥的单质是电解⑥的氧化物而不是氯化物的原因____________。
(5)⑤和⑧形成的离子化合物其晶胞结构如下图。该离子化合物晶胞的边长为 a cm,则晶体的密度是_________g·cm-3(只要求列出算式)。 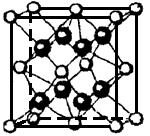
参考答案:(1)[Ar]3d54s1? ;Cr
(2)sp2?
本题解析:
本题难度:一般
2、简答题 (I)CH3+、CH3-、CH3-都是重要的有机反应中间体,有关它们的说法正确的是______.
A.它们均由甲烷去掉一个氢原子所得
B.它们互为等电子体,碳原子均采取sp2杂化
C.CH3-与NH3、H3O+互为等电子体,几何构型均为三角锥形
D.CH3+中的碳原子采取sp2杂化,所有原子均共面
E.两个CH3-或一个CH3+和CH3-结合均可得到CH3CH3
(II)锌是一种重要的金属,锌及其化合物有着广泛的应用.
(1)指出锌在周期表中的位置:______周期,______族,______区.
(2)葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂.写出Zn2+基态电子排布式______;葡萄糖分子中碳原子杂化方式有______.
(3)Zn2+能与NH3形成配离子[Zn(NH3)4]2+.配位体NH3分子属于______(填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在图1中表示[Zn(NH3)4]2+中Zn2+与N之间的化学键.
(4)图2表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为______;该化合物的晶体熔点比干冰高得多,原因是______.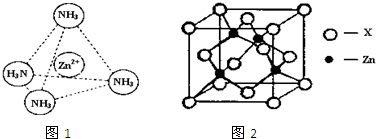
参考答案:(1)A.甲烷分子变成CH3+、CH3-、CH3-时,失去的
本题解析:
本题难度:一般
3、选择题
A.全部由非金属元素组成的化合物一定不是离子化合物
B.金属原子与非金属原子之间的化学键可能是离子键,也可能是共价键
C.晶体中有阳离子,则必定有阴离子
D.晶体中有阴离子,则必定有阳离子
参考答案:A、C
本题解析:A.NH4Cl为全部由非金属元素组成的离子化合物,故A错。
B.金属原子与非金属原子之间的结合,并不一定靠完全得失电子形成阴、阳离子来以离子键结合;如在AlCl3分子中,Al与Cl原子间靠共用电子对结合。又如在KMnO4里的MnO4—,Mn与O之间,NaAlO2里的AlO2—,Al与O之间都是靠共价键结合的,只不过是共用电子对靠近非金属原子而使其呈负价、金属原子显正价。所以B项正确。
C.在金属晶体中,只有阳离子和自由电子,没有阴离子;但凡是有阴离子的晶体中,非要有阳离子不可,以确保电中性。所
本题难度:一般
4、填空题 在干冰晶体中每个CO2分子周围紧邻的CO2分子有___________个在晶体中截取一个最小的正方形;使正方形的四个顶点部落到CO2分子的中心,则在这个正方形的平面上有___________个CO2分子。 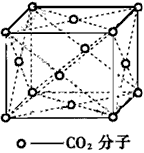
参考答案:12;4
本题解析:
本题难度:一般
5、选择题 下列物质的熔点由高到低排列的顺序为(??)


①NaCl?②金刚石?③CO2?④晶体硅?⑤CS2
A.②①⑤④③
B.②④①③⑤
C.②④①⑤③
D.④②①⑤③
参考答案:C
本题解析:略
本题难度:简单