时间:2017-01-15 15:49:32
1、选择题 下列反应的反应热ΔH>0的是
A.氢氧化钠与盐酸反应
B.氢氧化钡晶体与氯化铵的反应
C.锌和盐酸的反应
D.碳的燃烧
参考答案:B
本题解析:
试题分析:氢氧化钠与盐酸反应,放热反应,故A错误;氢氧化钡晶体与氯化铵的反应,吸热反应,故B正确;锌和盐酸的反应,放热反应,故C错误;碳的燃烧,放热反应,故D错误。
考点:本题考查化学反应与能量。
本题难度:一般
2、选择题 下列气态氢化物中最稳定的是
A.H2O
B.PH3
C.HF
D.NH3
参考答案:C
本题解析:元素非金属性越强越容易形成气态氢化物,形成的气态氢化物越稳定,同周期元素从左到右非金属性增强,同主族元素从上到下非金属性依次减弱,非金属强弱顺序:
F>O>N,O>S,S>P,所以O、P、F、N四元素中非金属性最强的是F。
本题难度:简单
3、选择题 下列说法正确的是
A.等量的硫蒸气和硫固体分别完全燃烧,前者放出热量多
B.电解池是将化学能转化为电能的装置
C.任何酸溶液与碱溶液发生中和反应生成1mol水时放出的热量一定是相等的
D.需要加热才能发生的反应一定是吸热反应
参考答案:A
本题解析:
试题分析:A.硫固体转化成硫蒸气需要吸热,所以等量的硫蒸气完全燃烧放出热量多,A正确;B.电解池是将电能转化为化学能的装置,B错误;C.浓硫酸与碱反应时,会因浓度变稀放出大量的热,醋酸在与碱反应时,会因电离吸收热量,所以它们反应生成1mol水时放出的热量不相等,C错误;D.需要加热才能发生的反应不一定是吸热反应,如木炭的燃烧是一个放热反应,但需要点燃,点燃的目的是使其达到着火点,D错误;选A。
考点:考查燃烧热及吸热反应、放热反应等基本概念的应用,电解池的定义。
本题难度:一般
4、选择题 既有离子键又有共价键的化合物是( )
A.Na2O
B.MgCl2
C.NaOH
D.H2O
参考答案:A、氧化钠中只有钠离子和氧离子之间的离子键,故A错误; 本题解析: 本题难度:简单 5、填空题 (11分)化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题: 参考答案:(1)AX3(l)+X2(g) = AX5(s) 本题解析: 本题难度:困难
(1)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成lmol AX5,放出热量123.8 kJ。该反应的热化学方程式为 。
(2)反应AX3(g)+X2(g) AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。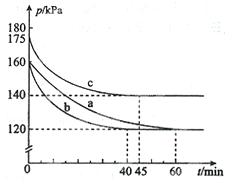
①列式计算实验a从反应开始至达到平衡时的反应速率v(AX5)= 。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为 (填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:b 、c 。
③用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为 。
试题分析:(1)根据题给信息,室温时AX3为液态,AX5为固态。室温时AX3与气体X2反应生成lmol AX5,放出热量123.8 kJ。该反应的热化学方程式为AX3(l)+X2(g) = AX5(s) ΔH=-123.8KJ·mol-1;(2)①根据题给信息和图像知,开始时no =" 0.4" mol,总压强为160 kPa,平衡时总压强为120 kPa,根据阿伏伽德罗定律则平衡时气体的总物质的量为0.30mol,利用三行式分析,设转化的AX5的物质的量为x
AX3(g) + X2(g)  AX5(g)
AX5(g)
起始量(mol) 0.20 0.20 0
平衡量(mol) 0.20 -x 0.20 -x x
(0.20-x)+(0.20-x)+x = 0.30,解得x = 0.10
则v(AX5)=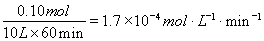 ;
;
②从图中观察平衡的时间(tb<tc<ta),判断反应速率的快慢为b>c>a;b组的反应速率加快,但平衡点没有改变说明是加人了催化剂;c组的反应速率加快,但平衡点向逆反应方向移动(或反应容器的容积和起始物质的量未改变,但起始总压强增大)说明是温度升高。③用三行式分析:
AX3(g) + X2(g)  AX5(g)
AX5(g)
起始量(mol) 0.20 0.20 0
变化量(mol) 0.20α 0.20α 0.20α
平衡量(mol) 0.20 -0.20α 0.20 -0.20α 0.20α
据题意有p0/p=0.4mol/(0.4—0.2?)mol,化简得α=2(1-p/p0)。
考点:考查热化学方程式的书写,化学反应速率的计算,化学平衡移动原理的应用,转化率的计算等。