时间:2017-01-15 15:38:42
1、选择题 下列说法错误的是[???? ]
A.原子及其离子的核外电子层数等于该元素所在的周期数
B.元素周期表中从ⅢB族到ⅡB族10个纵行的元素都属于金属元素
C.除氦外的稀有气体原子的最外层电子数都是8
D.同一元素的各种同位素的物理性质、化学性质均相同
参考答案:A
本题解析:
本题难度:简单
2、选择题 已知A、B、C、D的原子序数都不超过18,它们的离子aA(n+1)+、bBn+、cC(n+1)-、dDn-均具有相同的电子层结构,则下列叙述正确的是
A.原子序数:a>b>c>d
B.离子半径:A(n+1)+>Bn+>C(n+1)->Dn-
C.离子还原性:A(n+1)+>Bn+,离子氧化性:C(n+1)->Dn-
D.单质还原性:B>A,单质氧化性:D>C
参考答案:D
本题解析:aA(n+1)+、bBn+、cC(n+1)-、dDn-均具有相同的电子层结构,则核外电子数相同,即a-n-1=b-n=c+n+1=d+n。其中AB属于金属,位于同一周期。CD属于非金属位于同一周期,且强于AB的上一周期。原子序数是a>b>d>c,A不正确。核外电子排布相同的微粒,其微粒半径随原子序数的增大而继续,即顺序为C(n+1)->Dn->Bn+>A(n+1)+,B不正确。金属性越强,阳离子的氧化性越弱。非金属性越强,阴离子的还原性越弱。金属性是B大于A。非金属性是D大于C,所以选项C不正确,D正确。答案选D。
本题难度:一般
3、推断题 (二选一)【物质结构】
A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大。第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为____________________。
(2)A的最高价氧化物对应的水化物分子中其中心原子采取_________杂化。
(3)已知A、C形成的化合物分子甲与B的单质分子结构相似,1mol甲中含有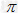 键的数目为__________。
键的数目为__________。
(4)D的核外电子排布式是_________________,它的高价离子与B的简单氢化物形成的配离子的化学式为_______________。
(5)D的氢化物的晶体结构如图所示,写出此氢化物在氯气中燃烧的化学方程式_________________________。 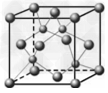
参考答案:(1)C<O<N
(2)sp2
(3)2NA(或
本题解析:
本题难度:一般
4、推断题 现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A,D同主族,C与E同主族,D、
E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子。
请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关):
(1)A~F六种元素原子,原子半径最大的是___________(填元素符号)
(2)A、C、D三种兀素组成的一种常见化合物是重要的工业产品,该化合物的电子式为__________;
(3)B与F两种元素形成的一种化合物分子,各原子均达8电子结构,其中B显负价,F显正价,则该化合物水解的 主要产物是__________;
(4)A、C、E三种元素形成的一种常见化合物,其浓溶液在加热条件下可与铜反应,该反应的化学方程式为____________________
参考答案:(1)Na
(2)本题解析:
本题难度:一般
5、选择题 X、Y、Z为短周期主族元素,在周期表位置关系如图,X为非金属元素.下列说法正确的是( )
A.Y和Z的最高价氧化物对应的水化物可能均为强酸
B.X的单质一定能与氧气反应
C.原子半径X>Y>Z
D.Y的单质一定不能与稀硫酸反应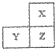
参考答案:A
本题解析:
本题难度:简单