时间:2017-01-15 15:38:23
1、选择题 下列反应属于放热反应的是
A.能量变化如图所示的反应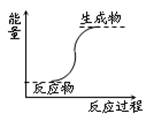
B.燃烧反应和铝热反应
C.化学键断裂吸收的热量比化学键生成放出的热量多的反应
D.氢氧化钡晶体和氯化铵晶体的反应
参考答案:B
本题解析:
试题分析:A、根据图示,反应物的能量低于生成物的能量,则该反应为吸热反应,故A错误;B、燃烧反应和铝热反应都是放热反应,故B正确;C、化学键断裂吸收的热量比化学键生成放出的热量多的反应为吸热反应,故C错误;D、氢氧化钡晶体和氯化铵晶体的反应为吸热反应,故D错误。
考点:本题考查化学反应的热效应。
本题难度:一般
2、选择题 在下列各物质中,属于分子晶体且分子间存在范德华力和氢键,分子内只含极性共价键的是?????????????(???)
A.CO2
B.H2O
C.HC1
D.NH4Cl
参考答案:
B
本题解析:
A中CO2分子内含O═C═O为极性共价键,但不存在氢键;B中H2O分子内H─O为极性共价键,分子间有氢键; HCl是分子晶体,分子间有范德华力,分子内为极性共价键;NH4Cl是由NH4+和Cl- 构成的离子晶体。
本题难度:简单
3、选择题 某澄清透明的浅黄色溶液中Fe3+,可能含有下列八种离子:H+、NH4+、Ba2+、Al3+、SO42-、HCO3-、
I-,在检验方案设计时初步分析其溶液中最多可含离子(不包括K+和OH-)有???????????????(???)
A.4种
B.5种
C.6种
D.7种
参考答案:A
本题解析:本题是离子共存的又一变型题。“澄清透明的浅黄色溶液中”有Fe3+,溶液中一定没有I-,会发生氧化还原反应。由于Fe3+存在于强酸溶液中,所以溶液中就不能存在HCO3-;但溶液中也必须有阴离子存在,只能是SO42-,就不能存在Ba2+,所以溶液中最多存在离子为H+、NH4+、Al3+、SO42-4种。
本题难度:简单
4、填空题 (12分)红磷P(s)和Cl2(g)发生反应生成 PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。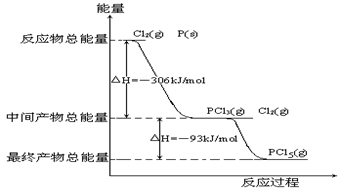
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式______________________________。
(2)PCl5分解成PCl3和Cl2的热化学方程式_________________ ____
(3)P和Cl2分两步反应生成1molPCl5的△H3=_________,P和Cl2一步反应生成1molPCl5的△H4______△H3(填“大于”、“小于”或“等于”)。
参考答案:本题解析:略
本题难度:一般
5、填空题 (10分)有下列分子或离子:(1)BF3???(2)H2O?(3) NH4+????
(4)SO2 ???(5)HCHO???(6)PCl3???(7)CO2
粒子构型为直线型的为?????:粒子的立体构型为V型的为?????:粒子的立体构型为平面三角形的为???????????:粒子的立体构型为三角锥型的为?????::粒子的立体构型为正四面体的为?????。
参考答案:(7);(2)和(4);?(1)和(5);(6);(3)
本题解析:根据价层电子对互斥理论可知,(1)、(3)、(5)、(7)的中心原子没有孤对电子。水中氧原子有2对孤对电子,SO2知硫原子有1对孤对电子。PCl3中磷原子有1对孤对电子,所以(1)、(5)平面三角形。(2)、(4)是V型。(3)是正四面体型。(6)是三角锥形,(7)是直线型。
本题难度:一般