时间:2017-01-15 15:36:44
1、填空题 工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业。
(1)若采用无隔膜法电解冷的食盐水时,Cl2会与NaOH充分接触,导致产物仅是NaClO和H2。无隔膜法电解冷的食盐水相应的离子方程式为 。
(2)氯碱工业耗能高,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。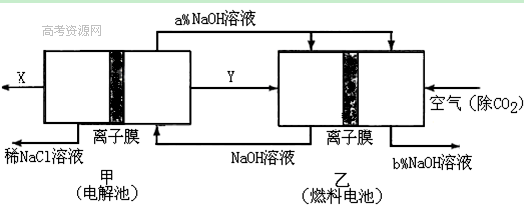
①经精制的饱和NaCl溶液应从图中电解池的 (填写“左” 或“右”)池注入。
②图中X是____ __(填化学式);乙中右室的电极反应式为: _ ,图示中氢氧化钠溶液质量分数a%与b%的关系是 (填字母)。
A. a%=b% B. a%
参考答案:
本题解析:
本题难度:困难
2、选择题 1L?0.1mol/L?AgNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极上增重2.16g时,下列判断正确的是(设电解按理论进行,溶液不蒸发)( )
A.溶液的浓度变为0.08mol/L
B.阳极上产生112mL?O2(标准状况)
C.转移的电子数是1.204×1022个
D.反应中有0.02mol的Ag被还原
参考答案:阳极电极反应为:Ag-e-=Ag+;
阴极电极反应为:
本题解析:
本题难度:简单
3、选择题 有三个烧杯,分别盛有CuCl2、KCl和AgNO3三种溶液,均以Pt作电极,将它们串联在一起电解一定时间,测得电极增重总和2.8克,这时产生的有色气体与无色气体的物质的量之比为(?? )
A.4∶1
B.1∶1
C.4∶3
D.3∶4
参考答案:C
本题解析:串联电路中,相同时间内各电极得失电子的物质的量相同,各电极上放出气体的物质的量之比为定值。不必注意电极增重是多少,只要判断出生成何种气体及生成该气体一定物质的量所得失电子的物质的量,就可以通过电子守恒,判断气体体积之比。第一只烧杯中放出Cl2,第二只烧杯中放出Cl2和H2,第三只烧杯中放出O2。在有1mol电子转移下,分别是0.5mol、0.5mol、0.5mol和0.25mol。所以共放出有色气体0.5mol+0.5mol=1mol,无色气体0.5mol+0.25mol=0.75mol。
本题难度:一般
4、选择题 电解100mL含c(H+)=0.3mol/L的下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是( 来源:91考试网 www.91exAm.org )
A.0.10mol∕LAg+
B.0.20mol∕LZn2+
C.0.20mol∕LCu2+
D.0.20mol∕LPb2+
参考答案:Zn2+和Pb2+的放电顺序都在H+后面,所以含有这两种阳离
本题解析:
本题难度:简单
5、选择题 10. 关于如图所示①、②两个装置的评价正确的是

参考答案:D
本题解析:
试题分析:A项装置①外加了电源,为电解池,装置②形成Zn、Cu原电池;B项电解稀硫酸实质是电解水,所以装置①中硫酸浓度增大,装置②的总反应为:Zn+H2SO4=ZnSO4+H2↑,硫酸浓度减小;C项电解硫酸溶液的阳极为OH?失电子:4OH--4e-=2H2O+O2↑,原电池的正极为H+得电子:2H++2e?=H2↑;D项电解池电解质溶液中阳离子向阴极移动,原电池电解质溶液中阳离子向正极移动。
考点:电解池和原电池的工作原理
点评:本题综合考查了化学电源的相关知识,注重考查学生分析问题的能力,难度不大,注意把握化学电源的工作原理。
本题难度:一般