时间:2017-01-13 11:12:52
1、选择题 将硫酸铵溶于水得无色溶液,为使该溶液中的铵根离子与硫酸根离子的物质的量浓度之比等于2,应当采取的措施是(??)
A.加入适量的硫酸溶液,抑制铵根离子的水解
B.加入适量的氨水,使pH值等于7
C.加入适量氢氧化钠,使溶液pH值等于7
D.加入适量硫酸钠,抑制硫酸铵电离
参考答案:B
本题解析:略
本题难度:一般
2、选择题 下列水解离子方程式正确的是
A.醋酸钠:CH3COOˉ+ H2O = CH3COOH + OHˉ
B.硫化钾:S2ˉ+ 2H2O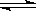 H2S +2 OHˉ
H2S +2 OHˉ
C.氯化铵: NH4+ + H2O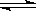 NH3·H2O + H+
NH3·H2O + H+
D.硫酸铁:Fe3+ +3 H2O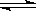 Fe(OH)3↓+3 H+
Fe(OH)3↓+3 H+
参考答案:C
本题解析:A错,正确为:CH3COOˉ+ H2O? CH3COOH + OHˉ;B错,正确为:S2ˉ+? H2O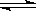 HS —+OHˉ;C正确;D错,正确为:Fe3+ +3 H2O
HS —+OHˉ;C正确;D错,正确为:Fe3+ +3 H2O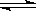
本题难度:简单
3、填空题 (14分)常温下,将0.01mol NH4Cl和0.002mol NaOH溶于水配成1L混合溶液,
(1)该溶液中存在的电离平衡是__ ____________________________________和________________________________,水解反应为_________________________。(用方程式表示)
(2)溶液中c( Na+ )=?????????????、c( Cl—)=?????????????
(3)c ( NH4+) ????????0.01mol/L(填 > 、 < 或=)
(4)写出溶液中电荷守恒的等式______________________________________????。
参考答案:(1)NH3·H2O 本题解析:略
本题难度:一般
4、选择题 为了使Na2S溶液中c(Na+)/c(S2-)的比值变小,可加入的物质是(???)
A.适量盐酸
B.适量NaOH
C.适量KOH
D.适量KHS
参考答案:A
本题解析:c(Na+)/c(S2-)=n(Na+)/n(S2-);要使比值变小,可减小钠离子或增大硫离子量;S2-+H2O HS-+OH-;加入碱或KHS,使平衡逆向移动,硫离子量增大,比值减小。故只有盐酸不行。
HS-+OH-;加入碱或KHS,使平衡逆向移动,硫离子量增大,比值减小。故只有盐酸不行。
本题难度:一般
5、选择题 下列溶液中微粒浓度关系不正确的是(??)
A.常温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)=c(NH4+)
B.pH=1的一元酸和pH=13的一元碱等体积混合:c(OH-)=c(H+)
C.0.1 mol·L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-)
D.0.1 mol·L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S)
参考答案:AC
本题解析:氨水与氯化铵的混合溶液中存在电荷守恒:c(NH4+)+c(H+)=c(OH-)+c(Cl-),常温下溶液pH=7,即c(H+)=c(OH-),所以c(NH4+)=c(Cl-),A项正确;选项B,没有指明酸、碱的强弱,故不能判断溶液的酸碱性,B项错;(NH4)2SO4中NH4+的水解是微弱的(水解显酸性),故0.1 mol·L-1的(NH4)2SO4溶液中:0.1 mol·L-1<c(NH4+)<0.2 mol·L-1,则有c(NH4+)>c(SO42-)>c(H+)>c(OH-),C项正确;硫化钠溶液中存
本题难度:一般