?
?
①表中3 min~4 min之间反应处于???????状态;cl数值???0.08? mol·L-1(填大于、小于或等于)。
②反应在4 min~5 min之间,平衡向逆方向移动,可能的原因是
a.增加水蒸气??? b.降低温度???? c.使用催化剂??? d.增加氢气浓度
(3)在相同温度下(850℃),若起始时c(CO)=1mol·L-1,C(H2O)=2mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态???????(填“是”与“否”),此时v(正)???????v(逆)(填“大于”“小于”或“等于”),你判断的依据是????????。
3、选择题 已知450℃时,反应H2(g)+I2(g)  ?2HI(g)的K=50,由此推测在450℃时,反应2HI(g) ?2HI(g)的K=50,由此推测在450℃时,反应2HI(g)  ?H2(g)+I2(g)的化学平衡常 数为 ?H2(g)+I2(g)的化学平衡常 数为
A.0.02
B.50
C.100
D.无法确定
4、选择题 已知HClO是比H2CO3还弱的酸,氯水中存在下列平衡:Cl2+H2O ?HCl+HClO;HClO ?HCl+HClO;HClO ?H++ClO-,达到平衡后,要使HClO的浓度增大,可加入下列物质: ?H++ClO-,达到平衡后,要使HClO的浓度增大,可加入下列物质:
A.SO2
B.NaHCO3
C.HCl
D.NaOH
5、填空题 反应aA(g)+bB(g)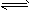 cC(g)+dD(g)在容积不变的密闭容器中达到平衡,且起始时A与B的物质的量之比为 cC(g)+dD(g)在容积不变的密闭容器中达到平衡,且起始时A与B的物质的量之比为
a:b,则:
(1)平衡时A、B的转化率之比是_________________。
(2)若同等倍数地增大A、B的物质的量浓度,且要使A与B的转化率同时增大,(a+b)与(c+d)所满足的关系是a+b_______c+d。填(>、<、=或没关系)
(3)若设定a=2,b=1,c=3,d=2,在甲、乙、丙、丁4个相同恒容容器中A的物质的量依次是2mol、
1mol、2mol、1mol,B的物质的量依次是1mol、1mol、2mol、2mol,C和D的物质的量均为0。则等温条件下达到平衡时,A的转化率最大的容器是______________,B转化率由大到小的顺序是_______________(填容器序号) 。
|  2NH3(g);△H
2NH3(g);△H <0,下列研究目的和示意图相符的是
<0,下列研究目的和示意图相符的是


