1、选择题 氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是(???)????????????????????????????????????????????????????
A.一个D2O分子所含的中子数为8
B.NH3的结构式为H—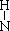 —H
—H
C.HCl的电子式为H+[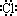 ]
]
D.热稳定性:H2S>HI
X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同
|
Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应
|
Z元素的族序数是其周期数的三倍
|
W原子的第一至第六电离能分别为:I1=578KJ·mol-1? I2=1817KJ·mol-1? I3=2745KJ·mol-1?I4=11575KJ·mol-1? I5=14830KJ·mol-1?? I6=18376KJ·mol-1
|
Q为前四周期中电负性最小的元素
|
元素R位于周期表的第10列
?
回答下列问题:
(1)Y元素的基态原子中未成对电子数为______;X、Y、Z三种元素原子的第一电离能由小到大的顺序为____________(用元素符号表示)。
(2)W的氯化物的熔点比Q的氯化物的熔点__________(填“高”或“低”),理由是__________________________________________________。
(3)光谱证实元素W的单质与强碱性溶液反应有[W(OH)4]-生成,则[W(OH)4]-中存在(填字母)_____________。
a.极性共价键???? b.非极性共价键???? c.配位键???? d.氢键
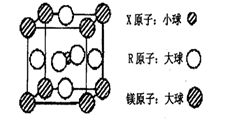
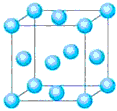
(4)含有X、R和镁三种元素的某种晶体具有超导性,其结构如下图所示。则该晶体的化学式为???????;晶体中每个镁原子周围距离最近的R原子有???????个。
3、填空题 下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
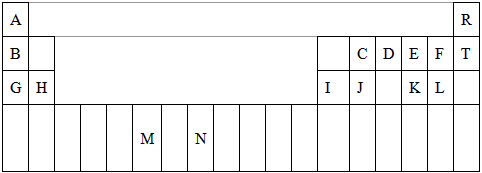
|
|
试回答下列问题
(1)请写出H的单质与二氧化碳反应的方程式________________________。
(2)D的气态氢化物的VSEPR模型为__________,其中心原子的杂化类型为__________________。
(3)G、H和I的第一电离能数值由大到小的顺序为:______________________(用元素符号作答)。
(4)由A、C、D形成的ACD分子中,含有__________个σ键,__________个π键。
(5)要证明太阳上是否含有R元素,可采用的方法是________________________。
(6)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。
请回答下列问题
①与M同周期的所有元素的基态原子中最外层电子数与M原子相同的元素还有_______________(填元素符号),其中一种金属的晶胞结构如图所示,该晶胞中含有金属原子的数目为_______________。
②MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2是__________(填“极性”或“非极性”)分子。
③在C2H4、CH3Cl、CH2O、CS2、CCl4五种有机化合物中,碳原子采取sp2杂化的分子有___________________________(填分子式)。
4、选择题 用价层电子互斥理论预测H2S和BF3的立体结构,两个结论正确的是
A.直线型;三角锥形
B.V形;三角锥形
C.直线型;平面三角形
D.V形;平面三角形
5、填空题 短周期元素T、Q、R、W、Z在元素周期表中的位置如图1所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
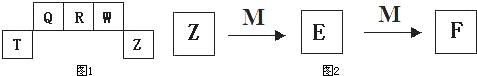
(1)Q的气态氢化物的分子式为______.其分子的空间结构为______结构.
(2)Z元素比R元素的非金属性强.能证明这一结论的事实是______(填序号).
①相同条件下,Z单质在水中的溶解性强于R单质
②Z单质与氢气化合比R单质与氢气化合容易
③Z的氢化物比R的氢化物稳定
(3)向T、Z元素形成的化合物的溶液中逐滴加入NaOH溶液,先产生白色沉淀;继续滴加NaOH溶液,直至沉淀溶解.写出沉淀溶解的反应离子方程式:______.
(4)QW和RW都是汽车尾气中含有的大气污染物,它们在汽车排气管的“催化转换器”中反应生成可参与大气生态循环的无毒气体,化学方程式为______.
(5)M是一种常见的金属单质,与元素Z的单质有如图2所示转化关系,则E转化为F的反应的离子方程式是______.
把一定量的M放入E溶液中,完全反应后,所得溶液中E、F的物质的量相等,则已反应的E与未反应的E的物质的量之比为______.
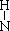 —H
—H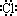 ]
]