10540
①某同学根据上述信息,推断B的核外电子排布如图所示,该同学所画的电子排布图违背了______。
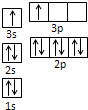
②ACl2分子中A的杂化类型为__________,ACl2空间构型为__________。
(2)已知C单质曾被称为“银色的金子”,与锂形成的合金常用于航天飞行器,其单质能溶于强酸和强碱。D是周期表中电负性最大的元素。E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物。请根据上述信息。
①写出E元素原子基态时的电子排布式____________________。
②以C单质、镁、NaOH溶液可以构成原电池,则负极的电极反应式为__________。
③D与Ca2+可形成离子化合物,其晶胞结构如图所示。其中Ca2+离子的配位数为__________,若该晶体的密度为ag/cm3,则该晶胞的体积是__________cm3(写出表达式即可)。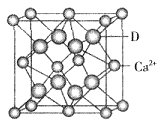
2、填空题 决定物质性质的重要因素是物质结构。请回答下列问题。
(1)下图是石墨的结构,其晶体中存在的作用力有???????(填序号)
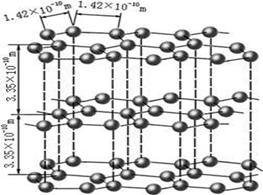
Aσ键;Bπ键;C氢键;D配位键;E分子间作用力;F金属键;G离子键
(2)下面关于晶体的说法不正确的是___________
A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4
B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:Na>Mg>Al
D.晶格能由大到小:NaF> NaCl> NaBr>NaI
(3)CaF2结构如图Ⅰ所示,Cu形成晶体的结构如Ⅲ所示,Ⅱ为H3BO3晶体结构图(层状结构,层内的H3BO3分子通过氢键结合)  ?? ??
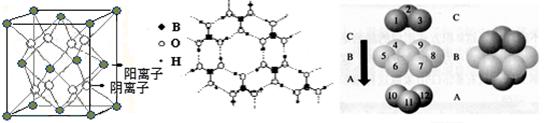
图Ⅰ?????????????????????????图Ⅱ????????????????????图Ⅲ
① 图I所示的晶体中与Ca2+离子最近且等距离的Ca2+离子数为????????????,
图III中未标号的Cu原子形成晶体后周围最紧邻的Cu原子数为??????????????;
②H3BO3晶体中B原子杂化方式______ ;
③三种晶体中熔点高低的顺序为??????????????????(填化学式),H3BO3晶体受热熔化时,克服的微粒之间的相互作用为?????????????????
(4) 碳的某种单质的晶胞如图所示,一个晶胞中有_____个碳原子;若该晶体的密度为ρ g/cm3,阿伏加德罗常数的值为NA,则晶体中最近的两个碳原子之间的距离为_???____cm(用代数式表示)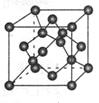
3、选择题 下列叙述正确的是(???)
A.氯化铯晶体中,每1个Cs+与其他8个Cs+等距离紧邻
B.金刚石网状结构中,由共价键构成的碳原子环中,最小的环上有4个碳原子
C.金属晶体的四种堆积模型中,六方最密堆积和面心立方最密堆积的空间利用率最高
D.PCl3和了BCl3分子中所有原子的最外层都达到8电子稳定结构
4、填空题 ?【化学――选修物质结构与性质】(15分)
有A、B、C、D、E五种元素。其相关信息如下:

请回答下列问题。
(1) 写出E元素原子基态时的电子排布式__________________;
(2) C元素的第一电离能比氧元索的第一电离能 ______ ______ (填“大”或“小”);
(3) CA3分子中C原子的杂化轨道类型是____________;
(4) A、C、E三种元素可形成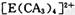 配离子,其中存在的化学键类型有 ______ (填序号); 配离子,其中存在的化学键类型有 ______ (填序号);
①配位键 ②金属键③极性共价键④非极性共价键⑤离子键 ⑥氢键
若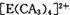 具有对称的空间构型,且当 具有对称的空间构型,且当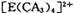 中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则 中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则 的空间构型为 ____________ (填序号); 的空间构型为 ____________ (填序号);
a.平面正方形b.正四面体c.三角锥型 ?d. V型
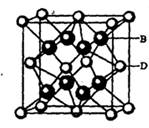
(5) B与D可形成离子化合物,其晶胞结构如右图所示。其中D离子的配位数为_____,若该晶体的密度为ag ? cm-3,则该晶胞的体积是______cm-3(写出表达式即可)。
5、选择题 下列结构图中,●代表前二周期元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表共价键。示例:F2 根据各图表示的结构特点,下列有关叙述正确的是 根据各图表示的结构特点,下列有关叙述正确的是
 [???? ] [???? ]
A.上述结构图中共出现6种元素
B.甲、乙、丙为非极性分子,丁为极性分子
C.甲与丁可以发生化合反应生成离子化合物
D.向CaCl2溶液中加入(或通入)丙有白色沉淀产生
| 
