时间:2017-01-13 10:06:26
1、实验题 面粉增白剂主要包括过氧化苯甲酰(俗称面粉增白剂)和过氧化钙两种物质。其中过氧化钙(CaO2) 在日常生活和工农业生产中还常用于种子消毒、药物制造、油脂漂白及鱼池增氧等,还可以作为高温氧化剂。已知:过氧化钙与CO2反应有气体生成,而将SO2通入过氧化钙粉末中也有气体生成。有人提出:
CO2、SO2与过氧化钙的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断。
实验一:通过测量气体的体积判断发生的化学反应,实验装置如下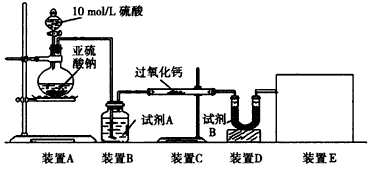
(1)试剂A可以选用____________,试剂B的作用是__________。
(2)装置E用于测定氧气的体积,请在方框中画出装置图。
(3)实验测得装置C中过氧化钙质量增加了m1g,装置D质量增加了m2g,装置E中收集到的气体为VL(已换算成标准状况下),用上述有关测量数据判断,SO2未被氧化、部分被氧化、完全被氧化的V-m1 关系式。未被氧化:__________,部分被氧化:__________, 完全被氧化:__________。若SO2完全被氧化,写出反应的化学方程式:___________________________。
实验二:向一定量的过氧化钠固体中通入足量的SO2,取反应后的固体进行实验探究,以证明过氧化物与SO2反应的特点。
(4)提出假设:
假设1:反应后固体中只有_______________,证明SO2未被氧化;
假设2:反应后固体中只有_______________,证明SO2完全被氧化;
假设3:____________________。
实验探究:
(5)设计实验,证明假设3是正确的,简要回答实验过程、现象和结论:___________________________。 实验评价:
(6)实验过程中SO2的通入量直接影响探究实验结果的科学性,请简要说明原因:__________。
参考答案:(1)浓硫酸;吸收未反应的SO2(2)
本题解析:
本题难度:困难
2、实验题 有一种工业废水,已知其中含有大量硫酸亚铁和少量银离子,某课外活动小组设计了一个既经济又合理的方法回收金属银和硫酸亚铁晶体。根据初中学过的知识,可推测他们实验的步骤是:在废水中加入____,充分反应后,被加入的试剂仍有剩余;取过滤后的滤渣加入足量___, 反应完全后,再经过滤,得到的滤渣是___。将两次过滤后的滤液合并,与过量铁片再充分反应后过滤,滤液经过____操作,可得到该溶质的晶体。
参考答案:足量的铁片 ;稀硫酸 ;银 蒸发、结晶
本题解析:
本题难度:一般
3、实验题 根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量Ar(Cu)(近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H2O),由此计算Ar (Cu)。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的NH4Cl与Ca(OH)2的量足以产生使CuO完全还原的氨气): 
请回答下列问题:
(1)氨气还原炽热氧化铜的化学方程式为____________________________;
(2)从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)a→__________________;
(3)在本实验中,若测得m(CuO)= a g,m(H2O)= b g,则Ar(Cu)= _______________;
(4)在本实验中,使测定结果Ar(Cu)偏大的是_______________ (填序号);
①CuO未完全起反应
② CuO不干燥
③CuO中混有不反应的杂质
④ 碱石灰不干燥
⑤NH4C1与Ca(OH)2混合物不干燥
(5)在本实验中,还可通过测定______和_____,或_____和______达到实验目的。
参考答案:(1)2NH3+3CuO本题解析:
本题难度:一般
4、填空题 (16分)黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取的主要原料。某化学学习小组对黄铁矿石进行如下实验探究:
[实验一]为测定硫元素的含量
I.将m1g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。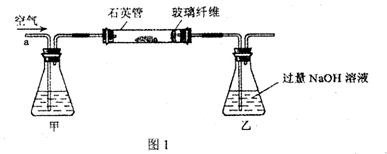
II.反应结束后,将乙瓶中的溶液进行如图2处理。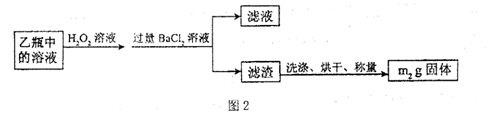
[实验二]测定铁元素的含量。III。测定铁元素含量的实验步骤如下:
①用足量稀硫酸溶解石英管中的固体残渣;
②加还原剂使溶液中的Fe3+完全转化为Fe2+后,过滤、洗涤;
③将滤液稀释至250mL;
④每次取稀释液25.00mL,用已知物质的量浓度为cmol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为VmL(该反应中还原产物为Mn2+)
请完成下列填空:
(1)已知12gFeS2完全燃烧放热85.3kJ,则FeS2燃烧热的化学方程式是??????????。
(2)I中,甲瓶内所盛试剂是????????溶液;乙瓶内发生反应的离子方程式有?????;I中玻璃纤维的作用是?????????????。
(3)II中,所加H2O2溶液需足量的理由是????????????。
(4)III的步骤③中,需要用到的仪器除烧杯、玻璃棒外,还有??????????;
(5)该黄铁矿中硫元素的质量分数?????????(用I、II中有关实验数据表达);该黄铁矿中铁的元素的质量分数?????????(用I、II中有关实验数据表达)
参考答案:(1)FeS2(s) + 11/4 O2 (g)= 1/2F
本题解析:I.黄铁矿灼烧的化学方程式为:FeS2+ 11/4 O2 = 1/2Fe2O3+ 2SO2,由题目所给数据可计算出1molFeS2完全反应所放出的热量为853kJ,则热化学方程式为:FeS2(s) + 11/4 O2 (g)= 1/2Fe2O3(s) + 2SO2(g) △H=-853KJ/mol
(2)I中,甲瓶内所盛试剂是为了吸收SO2,一般用碱液NaOH溶液:SO2 + 2OH- = SO32- + H2O;I中玻璃纤维主要是为了防止粉尘进入导管和乙装置,以防造成实验误差
(3)乙中为亚硫酸盐,加入过量双氧水是为了将SO32-全部氧化SO42-
(4)将滤液稀释至250mL主要应用容量瓶进行操作,期间需要用到胶头滴管、量筒等仪器
(5)由S~BaSO4可知,硫元素的质量分数为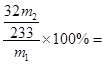 32m2/233m1×100%
32m2/233m1×100%
由5Fe~5Fe2+~KMnO4可知,铁元素的质量分数为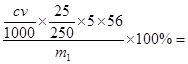 2.8cV/m1×100%
2.8cV/m1×100%
本题难度:一般
5、选择题 下列实验中,依据实验操作及现象,得出的结论正确的是
| ? | 操作 | 现象 | 结论 |
| A | 用CH3COOH溶液浸泡水垢 | 水垢溶解,有无色气泡 | 酸性:CH3COOH>H2CO3 |
| ? B | 测定等浓度的Na2CO3和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
| C | 向FeBr2溶液中通入过量Cl2 | 溶液由浅绿色变成黄色 | 氧化性:Br2>Fe3+ |
| D | 用石墨电极电解滴有酚酞的饱和NaCl溶液 | 在阴极附近溶液呈现红色 | 离子移动方向:OH-移向阴极 参考答案:A 本题解析:A 正确 强酸制弱酸,醋酸的酸性大于碳酸的酸性,所以,醋酸能溶解水垢,产生无色气泡。 本题难度:一般 |