时间:2017-01-13 09:51:22
1、选择题 下列说法正确的是[???? ]
A.含有金属元素的化合物一定是离子化合物
B.IA族和ⅦA族原子化合时,一定生成离子键
C.完全由非金属元素形成的化合物可能是离子化合物
D.活泼金属与非金属化合时,一定能形成离子键
2、选择题 关于晶体的下列说法正确的是[???? ]
A.只要含有金属阳离子的晶体就一定是离子晶体
B.离子晶体中一定含金属阳离子
C.在共价化合物分子中各原子都形成8电子结构
D.分子晶体的熔点不一定比金属晶钵熔点低
3、简答题 下表是周期表的一部分,表中所列的字母分别代表某一化学元素.
(1)下列______(填写编号)组元素的单质可能都是电的良导体.
①a、c、h??②b、g、k
③c、h、l??④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.核外电子离开该原子或离子所需要的能量主要受两大因素的影响:原子核对核外电子的吸引力;形成稳定结构的倾向.
一些原子核失去核外不同电子所需的能量(kJ?mol-1)
锂
X
Y
失去第一个电子
519
502
580
失去第二个电子
7?296
4?570
1?820
失去第三个电子
11?799
6?920
2?750
失去第四个电子
9?550
11?600
①通过上述信息和表中的数据分析,为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量______.
②表中X可能为以上13种元素中的______(填写字母)元素.用元素符号表示X和j形成的化合物的化学式______.
③Y是周期表中______族元素.
④以上13种元素中,______(填写字母)元素原子失去核外第一个电子需要的能量最多.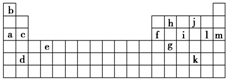
4、填空题 纳米技术制成的金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 离能(kJ·mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 ? (1)某同学根据上述信息,推断B的核外电子排布如图所示,该同学所画的电子排布图违背了________。 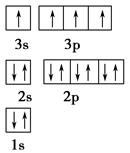 (2)ACl2分子中A的杂化类型为________。 (3)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。已知金刚石中的C—C的键长为154.45 pm,C60中C—C键长为145~140 pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确________,并阐述理由___________________。 (4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。写出基态钾原子的价电子排布式______________,该物质的K原子和C60分子的个数比为________。 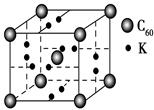 (5)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是______________________________,NCl3分子的VSEPR模型为________。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则一个Si60分子中π键的数目为________。 5、选择题 三氯化磷分子的空间构型是三角锥形而不是平面正三角形,下列关于三氯化磷分子空间构型理由的叙述,不正确的是( ) |