3、选择题 向25.00mL 0.1000mol/L?NaOH溶液中逐滴加入0.1000mol/L?CH3COOH溶液,溶液pH变化曲线如图所示,下列有关判断错误的是( )
A.在A点,溶液的pH=13
B.在B点,c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
C.在C点,c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.在D点,c(CH3COO-)+c(CH3COOH)=2c(Na+)
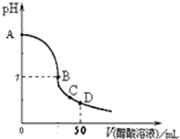
参考答案:C
本题解析:
本题难度:一般
4、计算题 常温下,将0.05mol/L盐酸溶液和未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的pH=12。用上述NaOH溶液13?ml和pH=3的某一元弱酸HA溶液20ml恰好完全反应生成NaA。试求:
(1)NaOH溶液的物质的量浓度
(2)此一元弱酸的物质的量浓度
(3)求此条件下该一元弱酸的电离平衡常数
参考答案:(1)c(NaOH)=0.04mol/L
(2)c(H
本题解析:
本题难度:一般
5、简答题 常温时,将V1mL?c1mol?L-1的氨水滴加到V2mL?c2moL?L-1的盐酸中,下列结论中正确的是______
A.若混合溶液的pH=7,则c1V1>c2V2??
B.若V1=V2,c1=c2,则溶液中c(NH4+)═c(Cl-)
C.若混合溶液的pH=7,则溶液中c(NH4+)>c(Cl-)
D.若V1=V2,且混合液的pH<7,则可能有c1═c2.
参考答案:A.由于一水合氨是弱碱,要使中和后的溶液为中性,碱应过量才行
本题解析:
本题难度:一般