时间:2017-01-13 09:46:25
1、选择题 液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是(??)
A.b极发生氧化反应
B.a极的反应式:N2H4+4OH--4e-=N2↑+4H2O
C.放电时,电流从a极经过负载流向b极
D.其中的离子交换膜需选用阳离子交换膜
参考答案:B
本题解析:
试题分析:通入燃料N2H4的电极a作负极,通入氧气的电极b作正极。负极发生反应N2H4+4OH--4e-=N2↑+4H2O;正极发生反应:O2+4e-+2H2O=4OH-.放电时电子从a极经过负载流向b极。电流则电流从b极经过负载流向a极. 由于在反应过程中不断消耗OH-或生成OH-离子。因此其中的离子交换膜需选用阴离子交换膜。根据上述分析可知正确选项为B.
本题难度:一般
2、选择题 现有A、B、C、D四种金属,把A、B分别浸入稀硫酸中,产生气泡都很慢;把C、D?分别浸入稀硫酸中,产生气泡都很快;把A、B用导线连接时,A上有气泡析出;把C浸入D的硝酸盐溶液中,C表面有D析出.这四种金属的活动性顺序由强到弱为:( )
A.C>D>B>A
B.C>D>A>B
C.D>C>A>B
D.D>C>B>A
参考答案:把A、B分别浸入稀硫酸中,产生气泡都很慢;把C、D?分别浸入
本题解析:
本题难度:一般
3、选择题 如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是
A.铁圈和银圈左右摇摆不定
B.保持平衡状态
C.铁圈向下倾斜
D.银圈向下倾斜
参考答案:D
本题解析:
试题分析:金属性是铁强于铜,铜强于银。所以当加入硫酸铜溶液后,从而构成原电池,其中铁是负极,失去电子。银是正极,溶液中的铜离子得到电子,在银表面析出,所以铁圈质量减小,银圈质量增加,故银圈向下倾斜,答案选D。
点评:该题是中等难度的试题,试题设计新颖,基础性强,注重答题的灵活性,有利于巩固基础,提高能力,也有利于培养学生的逻辑推理能力和发散思维能力。该题的关键是明确原电池工作原理,然后结合题意灵活运用即可,有利于提升学生的学科素养。
本题难度:一般
4、填空题 氢气是一种新型的绿色能源,又是一种重要的化工原料。
(1)氢气燃烧热值高。实验测得,在常温常压下,1g H2完全燃烧生成液态水,放出142.9 kJ热量。则H2
燃烧的热化学方程式为__________________________________。
(2)氢氧燃料电池能量转化率高,具有广阔的发展前景。现氢氧燃料电池进行下图所示实验:
①氢氧燃料电池中,正极的电极反应式为____________ 
②上图装置中,某一铜电极的质量减轻3.2g,则a极上消耗的O2在标准状况下的体积为____________L
(3)氢气是合成氨的重要原料,合成氨反应的热化方程式如下:N2(g)+3H2(g) 2NH3(g);
2NH3(g);
ΔH=-92.4 kJ/mol
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。 
图中t1时引起平衡移动的条件可能是____________其中表示平衡混合物中NH3的含量最高的一段时间是
____________
②温度为T℃时,将2a mol H2和amol N2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%。则反应的平衡常数为____________。
参考答案:(1)2H2(g)+O2(g)==2H2O(l);ΔH=-5
本题解析:
本题难度:困难
5、填空题 (13分)U、W、X、Y、Z都是短周期元素,且原子序数依次增大。W的气态氢化物甲和W的最高价氧化物对应的水化物可以化合生成盐,U与X可形成常温下呈液态的分子乙,甲、乙均为常见的10 电子分子;Y元素原子的K层电子数与M层电子数相同;Z元素的单质是太阳能转换为电能的常用材料。请回答问题:
(1)Z元素在周期表中的位置 。
(2)X、Y、Z三种元素的原子半径由小到大的顺序是 (用元素符号表示)。
(3)U与X形成的18电子化合物的电子式是 。
(4)(3)中描述的化合物含有的化学键有 。
a.离子键 b.极性共价键 c.非极性共价键
(5)已知:① N2(g)+3H2(g)=2NH3(g) ΔH=-92.4kJ/mol
②2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ/mol
试写出氨气完全燃烧生成气态水和氮气的热化学方程式 。
(6)有人设想寻求合适的催化剂和电极材料,以U2、W2为电极反应物,以HCl—NH4Cl溶液为电解质溶液制造新型燃料电池,试写出该电池的正极电极反应式: ;溶液中H+移向 (填“正”或“负”)极。
参考答案:(1)第三周期ⅣA族;(2)O<Si<Mg;(3
本题解析:
试题分析:W的气态氢化物甲和W的最高价氧化物对应的水化物可以化合生成盐,说明氢化物和最高价氧化物的水化物属于碱、酸,即W:N,气态氢化物甲:NH3,U与X可形成常温下呈液态的分子乙且乙是10e-的微粒,乙:H2O,即U:H、X:O,Y 元素原子的 K 层电子数与M层电子数相同,则Y的原子序数:12,即Y:Mg,Z元素的单质是太阳能转换为电能的常用材料,是硅单质的性质,则Z:Si,(1)Z:Si,属于第三周期ⅣA族元素;(2)原子半径大小①看电子层数,电子层数越多,半径越大②同周期从左向右原子半径依次减小,则O、Mg、Si的原子半径由小到大的顺序:O<Si<Mg;(3)H和O组成的18电子的化合物为H2O2,其电子式: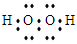 ;(4)根据化合物的电子式,推出含有极性共价键、非极性共价键,bc正确;(5) 氨气燃烧的化学反应方程式:4NH3+3O2=2N2+6H2O,②×3-①×2得:4NH3(g)+3O2(g)=2N2(g)+6H2O(l),△H=-483.6×3+92.4×2kJ·mol-1=-1266kJ·mol-1,整理解得:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ?H=-1266KJ/mol ;(6)氢气和氮气在酸性介质中,构成原电池,相当于氢气和氮气反应生成氨气,化合价降低的物质在正极上参加反应:N2+8H++6e-=2NH4+,根据原电池的工作原理阳离子向正极移动,阴离子向负极移动。
;(4)根据化合物的电子式,推出含有极性共价键、非极性共价键,bc正确;(5) 氨气燃烧的化学反应方程式:4NH3+3O2=2N2+6H2O,②×3-①×2得:4NH3(g)+3O2(g)=2N2(g)+6H2O(l),△H=-483.6×3+92.4×2kJ·mol-1=-1266kJ·mol-1,整理解得:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ?H=-1266KJ/mol ;(6)氢气和氮气在酸性介质中,构成原电池,相当于氢气和氮气反应生成氨气,化合价降低的物质在正极上参加反应:N2+8H++6e-=2NH4+,根据原电池的工作原理阳离子向正极移动,阴离子向负极移动。
考点:考查元素周期表、元素及其化合物的性质。
本题难度:一般