时间:2017-01-13 09:45:26
1、选择题 下列离子化合物,熔点最高的是(??? )
A.氯化钠
B.氯化钾
C.氯化锂
D.氯化铯
参考答案:C
本题解析:离子晶体离子间作用力越大,熔点越高。所以C项符合题意。
本题难度:简单
2、简答题 A.不锈钢是由铁、铬、镍、碳及众多不同元素所组成的合金,铁是主要成分元素,铬是第一主要的合金元素.其中铬的含量不能低于11%,不然就不能生成致密氧化膜CrO3防止腐蚀.
(1)基态碳(C)原子的轨道表示式为______.
(2)[Cr(H2O)4Cl2]Cl?2H2O中Cr的配位数为______;已知CrO5中Cr为+6价,则CrO5的结构式为______.
(3)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈四面体构型.423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉.试推测:四羰基镍的晶体类型是______,与Ni(CO)4中配体互为等电子的离子是______.
(4)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到A~B图中正确的是______.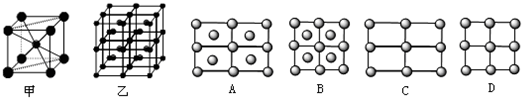
(5)据报道,只含镁、镍和碳三种元素的晶体竟然具有超导性.鉴于这三种元素都是常见元素,从而引起广泛关注.该晶体的结构可看作由镁原子和镍原子在一起进行面心立方密堆积,试写出该晶体的化学式______.晶体中每个镁原子周围距离最近的镍原子有______个.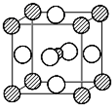
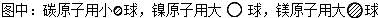
参考答案:(1)碳原子核外有6个电子,根据电子排布规律知,其轨道表示式
本题解析:
本题难度:一般
3、选择题 下列叙述正确的是(??? )
A.胶体溶液的电泳现象说明胶体带电荷
B.含有非极性键的化合物一定为共价化合物
C.原子晶体中共价键越强其熔点越高,如晶体硅比Si02熔点高
D.含有阴离子的物质必然含有阳离子.但含有阳离子的物质不一定含有阴离子
参考答案:D
本题解析:略
本题难度:简单
4、填空题 (10分)有A、B、C、D、E、F六种元素,已知:它们位于三个不同短周期,核电荷数依次增大;A与E、B与F分别同主族;A、E分别都能与D按原子个数比1﹕1或2﹕l形成化合物;B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物。
⑴写出只含有A、B、D、E四种元素的两种常见无水盐的化学式_____________。
⑵下图是A与D形成的一种化合物的晶体结构示意图,其中的虚线表示__________。E与D按原子个数比1﹕1形成的化合物的电子式为_____________________。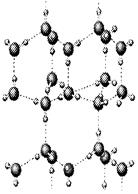
⑶人们通常把拆开l mol某化学键所吸收的能量看成该
化学键的键能。键能的大小可以衡量化学键的强弱,也可以 用于估算化学反应的反应热(△H),化学反应的△H等于反应
用于估算化学反应的反应热(△H),化学反应的△H等于反应
中断裂旧化学键的键能之和与反应中形成新化学键的键能之和
的差。下表列出了上述部分元素形成的化学键的键能:
| 化学键 | F—D | F—F | B—B | F—B | C═D | D═D |
| 键能/kJ·mol-1 | 460 | 176 | 347.7 | 347 | 745 | 497.3 ①下列三种物质形成的晶体,熔点由高到低的顺序(用a、b、c表示):_________。 a.F与B形成的化合物? b.B与D形成的稳定化合物? c.F的单质 ②试估算F单质晶体的燃烧热:____________________________________。 参考答案:(1)NaHCO3、CH3COONa? (2)氢键? 本题解析:考查元素周期表的结构、晶体的判断及有关反应热的计算。 本题难度:一般 5、填空题 ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题: 参考答案:(12分)[(4)、(5)两题每空1分,其余每空2分] 本题解析: 本题难度:一般 |