时间:2017-01-13 09:43:27
1、选择题 常温下用0.10 mol /L KOH溶液,滴定0.10 mol /L CH3COOH溶液,有关滴定过程中的说法正确的是
A.滴定终点时:溶液的pH=7
B.滴定终点时:c(K+) = c(CH3COO- ),c(H+) < c(OH-)
),c(H+) < c(OH-)
C.当溶液pH=7时:c(K+) =  c(CH3COO-) + c
c(CH3COO-) + c (CH3COOH)
(CH3COOH)
D.接近滴定终点时:c(K+) + c(H+) = c(CH3COO-) + c(OH-)
参考答案:D
本题解析:略
本题难度:一般
2、选择题 常温下,下列离子能使纯水中的H+离子数目增加的是
A.NH4+
B.CO32-
C.S2-
D.Na+
参考答案:A
本题解析:
试题分析:由水的电离可知,H2O?H++OH-,A选项,铵离子与OH-形成氨水若电解质,水电离平衡向正反应方向移动,H+数目增加。B选项,碳酸氢根与氢离子结合形成碳酸氢根弱电解质,消耗H+,故数目减少。C选项,S2-+H+?H2S,消耗氢离子,氢离子数目减少。D选项,对氢离子数目无影响。
本题难度:一般
3、选择题 下列有关盐类水解的说法不正确的是()
A.盐类的水解过程破坏了纯水的电离平衡
B.盐类的水解是酸碱中和反应的逆反应
C.盐类水解的结果使盐溶液不一定显中性
D.Na2CO3溶液中c(Na+)是c(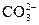 )的2倍
)的2倍
参考答案:D
本题解析:由于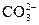 水解,故c(Na+)>2c(
水解,故c(Na+)>2c(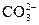 )。
)。
本题难度:简单
4、选择题 在蒸发发皿中加热蒸干并灼烧(低于400℃)下列的溶液,可以得到该物质的固体是
A.氯化镁溶液
B.硫酸铵溶液
C.碳酸氢钠溶液
D.硫酸铝溶液
参考答案:D
本题解析:
试题分析:氯化镁在溶液中存在水解平衡,加热促进水解,且生成的氯化氢以及挥发,进一步促进水解,属于最终得到的是氢氧化镁。硫酸铵是铵盐。加热易分解。碳酸氢钠稳定性差,加热易分解生成碳酸钠。硫酸铝在溶液中也存在铝离子的水解平衡,但由于生成的硫酸是难挥发性的,所以最终仍然得到硫酸铝,答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的应试能力。
本题难度:简单
5、选择题 100℃时,下列各溶液中,离子的物质的量浓度关系正确的是:
A.pH=11的氨水中:c(OH-)=3.0mol·L-1
B.呈中性的醋酸和醋酸钠的混合溶液中:c(Na+)=c(CH3COO-)
C.pH=2的稀盐酸中,c(H+)=c(Cl-)
D.pH=8的Na2SO3溶液中,c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)
参考答案:B
本题解析:
试题分析:A、没有确定溶液的温度,因此pH=11的氨水中c(OH-)不一定等于3.0mol·L-1,A不正确;B、根据电荷守恒可知c(Na+)+ c(H+)=c(CH3COO-)+ c(OH-),溶液显中性c(OH-)=c(H+),所以c(Na+)=c(CH3COO-),B正确;C、根据电荷守恒可知pH=2的稀盐酸中,c(H+)=c(Cl-) + c(OH-),C不正确;D、pH=8的Na2SO3溶液中显碱性,则c(Na+)>c(SO32-)>c(OH-) >c(HSO3-),D不正确,答案选B。
本题难度:一般