时间:2017-01-13 09:38:13
1、选择题 下列说法中不正确的是 [???? ]
A.离子化合物一定存在离子键
B.存在共价键的物质不一定是共价化合物
C.离子化合物中可能存在共价键
D.共价化合物中可能存在离子键
参考答案:D
本题解析:
本题难度:简单
2、选择题 下列有关化学用语表示正确的是( )
A.乙炔的电子式:H:C:;C:H
B.对甲基苯酚的结构简式: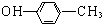
C.3,3-二甲基-1-戊烯的键线式: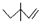
D.乙醇分子的比例模型: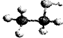
参考答案:C
本题解析:
本题难度:简单
3、填空题 以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点。回答下列问题:
(1)镓为元素周期表第31号元素,镓原子价层电子排布图为__________________。
(2)氮所在主族中第一电离能最大的元素是___________(填元素符号,下同),镓所在主族中电负性最大的元素是_____________________。
(3)传统的氮化镓制备方法是采用CaCl3与NH3在一定条件下反应,该反应的化学方程式为_________________。
(4)氮化镓与金刚石具有相似的晶体结构,氮化镓中氮原子与镓原子之间以__________相结合,氮化镓属于______________晶体。
(5)下图是氮化镓的晶胞模型: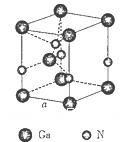
①氮化镓中镓原子的杂化方式为_______________,氮原子的配位数为__________________。
②氮化镓为立方晶胞,氮化镓的密度为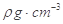 。列出计算氮化镓晶胞边长a的表达式:a=_______cm。
。列出计算氮化镓晶胞边长a的表达式:a=_______cm。
参考答案:(1)本题解析:
试题分析:(1)镓为元素周期表第31号元素,在元素周期表中的位置是位于第四周期第ⅢA。镓原子价层电子排布图为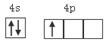 。(2)氮在第ⅤA.在第ⅤA的元素中,由于N原子半径最小,原子核外的最外层电子处于半充满的稳定状态。所以其第一电离能最大。镓在元素周期表第ⅢA。该主族中元素中电负性最大的元素是原子半径最小的B元素
。(2)氮在第ⅤA.在第ⅤA的元素中,由于N原子半径最小,原子核外的最外层电子处于半充满的稳定状态。所以其第一电离能最大。镓在元素周期表第ⅢA。该主族中元素中电负性最大的元素是原子半径最小的B元素
本题难度:困难
4、选择题 短周期元素X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍,下列说法正确的是 [???? ]
A.X的最高价氧化物对应的水化物显弱酸性
B.Y的氧化物是离子化合物
C.X的氢化物的水溶液在空气中存放不易变质
D.X的氢化物和Z的氢化物反应生成一种对热稳定的化合物
参考答案:B
本题解析:
本题难度:一般
5、选择题 已知信息:[Cu(NH3)4]SO4的电离方程式为:[Cu(NH3)4]SO4=[Cu(NH3)4]2++SO42-。 具有6个配体的Co3+的配合物CoClm·n NH3,若1 mol此配合物与足量的AgNO3溶液反应只生成1 mol AgCl沉淀,则m、n的值分别是
A.m=1,n=5
B.m=3,n=4
C.m=5,n=1
D.m=3,n=3
参考答案:B
本题解析:
试题分析:1 mol此配合物与足量的AgNO3溶液反应只生成1 mol AgCl沉淀,这说明分子中有1个氯离子不是配体。又因为钴元素是+3价的,所以m=3。由于配位数是6,则n=4,答案选B。
点评:该题是中等难度的试题,主要是考查学生对配位健含义以及形成特点的熟悉了解程度,旨在培养学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑思维能力和创新思维能力。
本题难度:简单