时间:2017-01-13 09:12:32
1、填空题 (10分)(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________。
A. KMnO4 B. H2O2 C. Cl2水 D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)。
参考答案:(1)B CD (2)4
本题解析:(1)B;过氧化氢为绿色氧化剂被还原后生成水,不引入新的杂质;
除杂质的同时不能引入新的杂质,正确选项为C、D;
(2)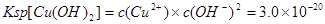 则
则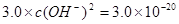 ,
, ,即POH=10,PH=4;
,即POH=10,PH=4; ,则
,则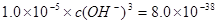 ,即可得PH=3.3;该方案可行;
,即可得PH=3.3;该方案可行;
本题难度:困难
2、选择题 下列说法正确的是
[???? ]
参考答案:C
本题解析:
本题难度:一般
3、填空题 (17分)铜在工农业生产中有着广泛的用途。
(1)配制CuSO4溶液时需加入少量稀H2SO4,其原因是 (只写离子方程式)。
(2)某同学利用制得的CuSO4溶液,进行以下实验探究。
①图甲是根据反应Fe+CuSO4=Cu+FeSO4设计成铁铜原电池,请图甲中的横线上完成标注。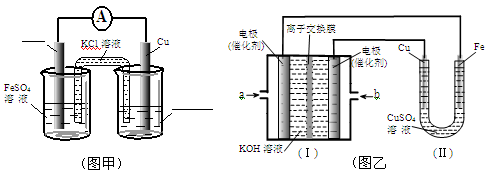
②图乙中,I是甲烷燃料电池的示意图,该同学想在II中实现铁上镀铜,则应在a处通入 (填“CH4”或“O2”),b处电极上发生的电极反应式为 ==4OH-;
若把II中电极均换为惰性电极,电解液换为含有0.1molNaCl溶液400mL,当阳极产生的气体为448mL(标准状况下)时,溶液的pH= (假设溶液体积变化忽略不计)。
(3)电池生产工业废水中常含有毒的Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去[室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2]。请结合离子方程式说明上述除杂的原理:当把FeS加入工业废水中后,直至FeS全部转化为CuS沉淀,从而除去溶液中Cu2+。
参考答案:(1)Cu2++2H2O本题解析:
试题分析:(1)加入稀硫酸是为了抑制Cu2+的水解;(2)图乙在Fe上镀铜,所以Fe作阴极,则连接的为燃料电池的负极,应通入CH4,b极通入O2发生还原反应:O2+4e-+2H2O =4OH-;电解池中均为惰性电极时,阳极的电极反应式为:2Cl--2e-=Cl2↑ ,阴极反应式为:2H++2e-=H2 ↑ .由电极反应式计算消耗的H+为0.04mol,则生成的OH-为0.04mol,c(OH-)=0.1mol/L,则c(H+)=10-13mol/L,pH=13;(3)应用了难溶电解质的沉淀溶解平衡,溶液中存在溶解平衡:FeS(s)  Fe 2+(aq)+ S 2-(aq),Cu2+与S 2-反应可生成溶度积更小的CuS沉淀,使得上述溶解平衡继续向右移动。
Fe 2+(aq)+ S 2-(aq),Cu2+与S 2-反应可生成溶度积更小的CuS沉淀,使得上述溶解平衡继续向右移动。
考点:盐类水解、原电池原理及计算、难溶电解质的沉淀溶解平衡。
本题难度:困难
4、选择题 得到较纯的FeS沉淀,应在FeCl2溶液中加入的试剂( )
A.(NH4)2S
B.Na2S
C.H2S
D.NaHS
参考答案:A、加入(NH4)2S,生成FeS沉淀,溶液中的NH4Cl水
本题解析:
本题难度:简单
5、选择题 已知BaCO3和BaSO4均为难溶电解质,其溶度积分别为Ksp(BaCO3)=5.1×10-9 mol2·L-2,Ksp(BaSO4)=1.1×10-10 mol2·L-2,则下列说法中正确的是(??)
A.BaSO4可做钡餐而BaCO3不能是因为Ksp(BaSO4)<Ksp(BaCO3)
B.在制腈纶纤维的1 L溶液中含SO42-为1.0×10-3 mol,则加入0.01 mol BaCl2不能使SO42-完全沉淀
C.在清理有关仪器的BaSO4沉淀时,常加入饱和Na2CO3溶液,使BaSO4转化为BaCO3再用酸处理
D.用稀H2SO4洗涤BaSO4效果比用水好,BaCO3也能用此法处理
参考答案:C
本题解析:A、是因为BaSO4比BaCO3稳定;
B、加入0.01molBaCl2,c(SO)===1.1×10-7,符合要求。
C、饱和Na2CO3溶液,增加碳酸根浓度,可以将BaSO4转化为BaCO3。
D、BaCO3溶于酸,故不能使用该方法。
本题难度:一般