时间:2017-01-13 09:12:32
1、计算题 摩尔盐[xFeSO4·y(NH4)2SO4·zH2O]是一种重要化工原料。其组成可通过下列实验测定:
①称取1.5680 g样品,准确配成100 mL溶液A。
②量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤,干燥至恒重,得到白色固体0.4660 g。
③再量取25.00 mL溶液A,滴加适量稀硫酸,用0.0200 mol·L-1KMnO4溶液滴定至终点,生成Mn2+,消耗KMnO4溶液10.00 mL。
(1)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO42-)≤1. 0×10-5mol·L-1,应保持溶液中c(Ba2+)
≥??????????mol·L-1。
(2)③中发生反应的离子方程式为?????????????,滴定终点的现象是??????????。
(3)通过计算确定样品的组成(必须写出计算过程)。
参考答案:
(1)1.1×10-5???????????????
本题解析:
试题分析:本题是测定物质组成的计算题。
(1)Ksp= c(Ba2+) × c(SO42-)=1.1×10-10????c(Ba2+)= 1.1×10-5 mol·L-1
(3)在步骤②中得到的白色固体为BaSO4,由此计算出SO42-的含量;在步骤③中根据反应方程式计算出溶液中含有的Fe2+的含量,再根据电荷守恒计算出溶液中含有NH4+的含量。但要注意所取的溶液只是原溶液的1/5,计算原溶液中SO42-和Fe2+的物质的量。最后根据总质量计算水的含量,确定组成。
本题难度:一般
2、选择题 下列有关硬水及其软化的说法中错误的是( )
A.离子交换法可以软化硬水
B.硬水中含有较多Ca2+、Mg2+
C.生产、生活使用的天然水必须经软化
D.加热可使暂时硬水中的Ca2+生成CaCO3沉淀
参考答案:A.离子交换法可以减小水中Ca2+、Mg2+等离子的含量,降
本题解析:
本题难度:一般
3、选择题 已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3
主要:Cu2++CO32-+H2O===Cu(OH)2↓+CO2↑
次要:Cu2++CO32-===CuCO3↓
(2)CuSO4+Na2S
主要:Cu2++S2-===CuS↓
次要:Cu2++S2-+2H2O===Cu(OH)2↓+H2S↑
下列几种物质的溶解度大小的比较中,正确的是[???? ]
A.CuS<Cu(OH)2<CuCO3
B.CuS>Cu(OH)2>CuCO3
C.Cu(OH)2>CuCO3>CuS
D.Cu(OH)2<CuCO3<CuS
参考答案:A
本题解析:
本题难度:一般
4、填空题 (6分)(1)硫化钠水溶液显碱性的原因_______________(用离子方程式表示)
(2)用硫化亚铁作沉淀剂除去污水中的Cu2+_______________________
(3)浑浊的石灰水中存在的溶解平衡________________
参考答案:(1)S2-+H2O本题解析:
试题分析:(1) 硫化钠是强碱弱酸盐,水解显碱性,水解离子方程式为S2-+H2O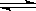 HS-+OH-(2)根据沉淀转化原理:溶解度小的可以转化为溶解度更小的沉淀,方程式为:Cu2++FeS= CuS+Fe2+(3)Ca(OH)2是微溶物,存在的溶解得平衡是:Ca(OH)2(S)
HS-+OH-(2)根据沉淀转化原理:溶解度小的可以转化为溶解度更小的沉淀,方程式为:Cu2++FeS= CuS+Fe2+(3)Ca(OH)2是微溶物,存在的溶解得平衡是:Ca(OH)2(S)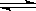 Ca2+ (aq)+2OH-(aq)
Ca2+ (aq)+2OH-(aq)
考点:水解,溶解平衡方程式的书写。
本题难度:一般
5、选择题 难溶电解质AB2饱和溶液中,c(A2+)=xmol·L-1,c(B-)=ymol·L-1,则Ksp值为[???? ]
A.1/2 xy2
B.xy
C.xy2
D.4xy2
参考答案:C
本题解析:
本题难度:一般