时间:2017-01-13 09:12:32
1、填空题 氨的合成原理为:N2(g)+3H2(g) 2NH3(g) ;△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如右图。回答下列问题:
2NH3(g) ;△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如右图。回答下列问题: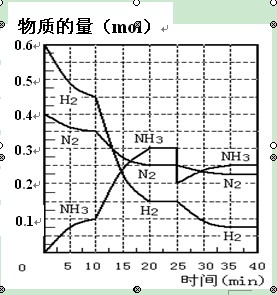
(1)10 min内以NH3表示的平均反应速率???????????????;
(2)在10 ~20 min内:NH3浓度变化的原因可能是 ??????????????????;
A.加了催化剂
B.缩小容器体积
C.降低温度
D.增加NH3物质的量
(3)第1次平衡的时间范围为:?????????????平衡常数K1 ="_____________" ??????????????(表达式),第2次平衡时NH3的体积分数 ??????????;
(4)在反应进行至25 min时, 曲线发生变化的原因:?????????????????
参考答案:(12分,每空2分)(1) v = 0.005 mol·L-
本题解析:
试题分析:(1)根据图像可知,10min时氨气的物质的量是0.1mol,所以氨气的反应速率是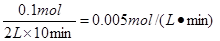 。
。
(2)根据图像可知,在10 ~20 min内NH3浓度增加,氮气和氢气的浓度减小,这说明反应向正反应方向进行。因为该反应是体积减小的、放热的可逆反应,所以改变的条件可能是缩小容器体积或降低温度,答案选B
本题难度:一般
2、选择题 有关AgCl的溶解沉淀平衡的说法中,不正确的是( )
A.达到沉淀溶解平衡时,AgCl沉淀生成和沉淀溶解不断进行,但速率相等
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.升高温度时,AgCl的溶解度增大
D.向AgCl饱和溶液中,加入NaCl固体,会析出AgCl固体
参考答案:A、达到沉淀溶解平衡时,AgCl沉淀生成和沉淀溶解不断进行,
本题解析:
本题难度:一般
3、简答题 用菱锌矿(主要成分为碳酸锌,还含有Fe2+、Fe3+、Mg2+、Ca2+、Cu2+等)制备氯化锌的一种流程如下:
(1)在反应3前要将菱锌矿研磨,其目的是______.
(2)反应4将Fe2+氧化为Fe3+,该反应的离子方程式为______.
(3)加入氧化锌调节pH=4.5,反应5的离子方程式为______、______.
(4)锌粉不在反应4之前加入的原因是______.
(5)若用石墨作电极电解滤液Y,则可以得到参与本流程反应的物质有______.
参考答案:(1)依据影响化学反应速率的因素分析判断,增大接触面积会增大
本题解析:
本题难度:一般
4、填空题 (5分)已知某溶液中只存在OH-、H+、CH3COO-、Na+四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Na+)>c(CH3COO-)>c(OH-)>c(H+)。
②c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
③c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
④c(CH3COO-)>c(Na+)> c(OH-) > c(H+)
(1)若溶液中只溶解了一种溶质,则该溶质是???????,上述四种离子浓度的大小顺序为??????(填编号)。
(2)若上述关系中③是正确的,则溶液中的溶质为????????。
(3)若该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好呈中性,则混合前两溶液的物质的量浓度大小关系为c(NaOH)??????c(CH3COOH)(填“大于”“小于”或“等于”,下同),混合前酸中c(H+)和碱中c(OH-)的关系是c(H+)?????c(OH-)。
参考答案:(10分)(1)醋酸钠?①
(2)CH3COONa和C
本题解析:略
本题难度:简单
5、选择题 向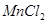 溶液中加入过量难溶电解质
溶液中加入过量难溶电解质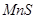 ,可使溶液中含有的
,可使溶液中含有的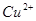 、
、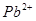 、
、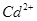 等金属离子转化为硫化物沉淀,从而得到纯净的
等金属离子转化为硫化物沉淀,从而得到纯净的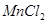 。下列分析正确的是
。下列分析正确的是
A.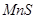 具有吸附性
具有吸附性
B.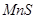 有还原性,将
有还原性,将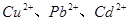 还原后除去
还原后除去
C.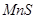 溶液度大于
溶液度大于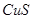 、
、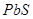 、
、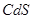
D.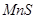 与
与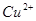 反应的离子方程式是
反应的离子方程式是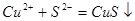
参考答案:C
本题解析:
试题分析:向溶液中加入过量难溶电解质MnS,可使溶液中含有的、、等金属离子转化为硫化物沉淀,说明生成的硫化物沉淀比MnS更难溶,符合沉淀的转化,MnS是难溶电解质,所以与Cu2+生成CuS沉淀时不能拆开,所以答案选C。
考点:考查沉淀的转化
本题难度:一般