时间:2017-01-13 08:58:17
1、选择题 如图是生活中常用的锌锰干电池的示意图,下列有关说法中不正确的是( )
A.电池内部含有电解质
B.锌是负极,碳棒是正极
C.电池用完后可埋入土壤
D.锌锰干电池属一次电池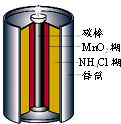
参考答案:A.锌锰干电池中氯化铵是电解质,故A正确;
B.锌锰干
本题解析:
本题难度:一般
2、填空题 (8分)约6cm长,2cm宽的铜片和铝片各一片,分别用接线柱平行地固定在一块塑料板上(间隔2cm),将铜片与铝片分别和电流表的“+”、“–”端相连结,电流表指针调到中间位置,取50 mL两只小烧杯,在一只烧杯中注入40mL浓HNO3,另一只烧杯中注入40mL稀硫酸,试回答下列问题:
①两电极同时插入稀H2SO4中,原电池的负极为______(填“铝”或“铜”)极,铝片上的电极反应式为:____________________________。
②两电极同时插入浓HNO3中,原电池的负极为_________(填“铝”或“铜”)极,铝片上的电极反应式为:_____________________________。
参考答案:(8分)每空各2分
铝,??? Al-3e-=Al3+
本题解析:(1)在电解质稀硫酸形成的原电池中,活性较强的铝为负极,失电子:Al-3e-=Al3+
(2)在电解质浓硝酸形成的原电池中,由于在常温下铝在浓硝酸中钝化,反而活性较差的铜失电子,做负极:Cu-2e-=Cul2+,溶液中的硝酸根离子在正极上得电子:NO3-+2H++e-=NO2+H2O
(可由总反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O减去负极反应面得到正极反应式)
本题难度:一般
3、选择题 下列各组材料中,不能组成原电池的是( )
| | A | B | C | D | ||||||||||||||||||||
| 两极材料 | Zn片、石墨 | Cu片、Ag片 | Zn片、Cu片 | Fe片、Cu片 | ||||||||||||||||||||
| 插入溶液 | H2SO4溶液 | AgNO3溶液 | 蔗糖溶液 | 稀盐酸 参考答案:C 本题解析:蔗糖属于非电解质溶液,不可能形成闭合回路。 本题难度:一般 4、填空题 如下图所示,可形成氢氧燃料电池。通常氢氧燃料电池有酸式(当电解质溶液为硫酸时)和碱式〔当电解质溶液为NaOH(aq)或KOH(aq)时〕两种。试回答下列问题: 参考答案:(1)2H2-4e-=4H+ O2+4e-+4H+=2H2O 本题解析:(1)正极上,O2得电子变为O2-,溶液中O2-不能单独存在;酸性条件下与H+结合生成H2O。负极上,H2失电子变为H+,H+进入电解质溶液。电池总反应为H2和O2生成水的反应,由于有水生成,溶液将逐渐变稀,故pH增大。 本题难度:一般 5、选择题 某原电池的总反应方程式为:2Fe3+ +Cu=== 2Fe2+ + Cu2+,能实现该反应的为( )
|