时间:2017-01-13 08:47:22
1、填空题 金属晶体是面心立方体,立方体的每个面5个金原子紧密堆砌(如图其余各面省略),金原子半径为d m,求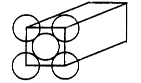
(1)金晶体中最小的一个立方体含有__________个金属原子。
(2) 欲计算一个晶胞的体积,除假定金原子是刚性小球外,还应假定?????????;
(3)计算一个晶胞的体积是?????????????????????cm3;
(4)金的密度为_________g?cm-3。
(5)列式计算金原子的空间利用率???????????????????????????????????
参考答案:(1)4??????? (2) 立体各面上对角线上的球相切?
本题解析:(1)根据面心立方体的晶胞结构可知,含有的原子有8×1/8+6×1/2=4。
(2)还应假定立方体各面上对角线上的球是相切的。
(3)设立方体的边长是x。因为面对角线的是4d m,所以边长x=2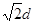 m。因此一个晶胞的体积是x3=16
m。因此一个晶胞的体积是x3=16 本题难度:一般
2、选择题 如图示意的是硼和镁形成的化合物的晶体结构单元;镁原子间形成正六棱柱,且棱柱的上下底面还各有一个镁原子,6个硼原子位于棱柱内。则该化合物的化学式可表示为? ( )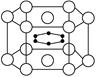
A.MgB
B.MgB2
C.Mg2B
D.Mg3B2
参考答案:B
本题解析:里面的B为6个,镁原子为12×1/6+2×1/2="3" 该化合物的化学式为 MgB2
本题难度:简单
3、填空题 Q、R、X、Y为前20号元素中的三种,Y22+、Q的低价氧化物都与X单质分子均为等电子体,R与Q同族。
⑴Q的最高价氧化物,其固体属于????????????晶体,比较Q、X、Y 第一电离能由大到小的顺序??????????????。
⑵ R的氢化物属于??????????分子(填“极性”或“非极性”)。
⑶X的常见氢化物的VSEPR模型是???????????;
⑷已知Ti3+可 形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种配合物晶体的样品配成待测溶液;b.分别往待测
形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种配合物晶体的样品配成待测溶液;b.分别往待测 溶液中滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3。则绿色晶体配合物的化学式为???????。
溶液中滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3。则绿色晶体配合物的化学式为???????。
参考答案:(1)分子;N>O>C。???(2)非极性???
本题解析:略
本题难度:简单
4、选择题 现有四种晶体,其离子排列方式如图所示,其中化学式不属于AB型的是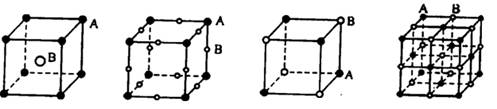
A????????????? B?????????????? C??????????????? D
参考答案:B
本题解析:选项A中,含有A原子是8×1/8=1,所以化学式为AB。选项B中,含有A原子是8×1/8=1,含有B原子是12×1/4=3,化学式为AB3。同样也可以计算出选项CD的化学式都是AB,因此答案选B。
本题难度:一般
5、选择题 我国前科学院院长卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素 (H2NCONH2)和H2O2形成加合物H2NCONH2·H2O2,不但使H2O2稳定下来,而且结构也没有发生改变,得到了可供做衍射实验的单晶体,经测定H2O2结构如 图所示,结合以上信息,下列说法不正确的是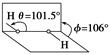
A.任何分子式中的“· ”都表示氢键
B.H2O2是极性分子,其结构简式为HO—OH
C.H2O2既有氧化性又有还原性
D.H2NCONH2与H2O2是通过氢键结合的
参考答案:A
本题解析:
试题分析:分子式中的“· ”不一定都表示氢键,选项A不正确;根据双氧水的结构示意图可知,选项BC正确,尿素 (H2NCONH2)和H2O2形成加合物H2NCONH2·H2O2,不但使H2O2稳定下来,而且结构也没有发生改变,这说明是通过氢键连接的,D正确,答案选A。
点评:该题是高考中的常见题型和考点,属于中等难度试题的考查,试题综合性强,侧重对学生能力的培养和训练,有利于培养学生的逻辑推理能力、自学能力和知识的迁移能力,提高学生的应试能力和学习效率。
本题难度:简单