时间:2017-01-13 08:43:44
1、填空题 NOx是汽车尾气中的主要污染物之一。
(1) NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:_ .
(2)汽车发动机工作时会引发N2和02反应,其能量变化示意图如下:
①写出该反应的热化学方程式: _ .
②随温度升高,该反应化学平衡常数的变化趋势是_ .。
(3)在汽车尾气系统中装置催化转化器,可有效降低NOX的排放。
①当尾气中空气不足时,NOX在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:_ .
② 当尾气中空气过量时,催化转化器中的金属氧化物吸收NOX生成盐。其吸收能力顺序如下:12MgO <2oCaO <38SrO<56BaO.原因是 .
(4)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
①Pt电极上发生的是 反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式: .
参考答案:
(1)3NO2+H2O=2HNO3+NO
(2
本题解析:由NO2制备硝酸3NO2+H2O===2HNO3+NO;根据题给能量关系可得到热化学反应方程式N2(g)+O2(g) 2NO(g) ΔH="+183kJ/mol" ,该反应为吸热反应,升高温度,平衡向右移动,K值增大;一氧化氮与一氧化碳的反应生成氮气2NO+2CO= N2+2CO;Mg、Ca、Sr、Ba为同一主族元素,从上到下,原子半径逐渐增大元素的金属性逐渐增强,金属氧化物对NOX的吸收能力逐渐增强;电化学反应Pt电极为正极发生还原反应,O2+4e-=2O2-,NiO电极为负极发生氧化反应NO-2e-+O2-=NO2。
2NO(g) ΔH="+183kJ/mol" ,该反应为吸热反应,升高温度,平衡向右移动,K值增大;一氧化氮与一氧化碳的反应生成氮气2NO+2CO= N2+2CO;Mg、Ca、Sr、Ba为同一主族元素,从上到下,原子半径逐渐增大元素的金属性逐渐增强,金属氧化物对NOX的吸收能力逐渐增强;电化学反应Pt电极为正极发生还原反应,O2+4e-=2O2-,NiO电极为负极发生氧化反应NO-2e-+O2-=NO2。
(1)NOx能形成酸雨,NO2转化为HNO3的化学方程式为3NO2+H2O=2HNO3+NO.
(2)①盖斯定律可得,该反应的热化学方程式为N2(g)+O2(g) 2NO(g);ΔH=+183kJ/mol.
2NO(g);ΔH=+183kJ/mol.
②该反应为吸热反应,随温度升高,该反应化学平衡常数K值增大。
(3)在汽车尾气系统中装置催化转化器,可有效降低NOX的排放。
①NO被CO还原的化学方程式为2NO+2CO= N2+2CO.
②Mg、Ca、Sr、Ba为同一主族元素,从上到下,原子半径逐渐增大元素的金属性逐渐增强,金属氧化物对NOX的吸收能力逐渐增强,元素的金属性逐渐增强,金属氧化物对NOX的吸收能力逐渐增强。
(4)①Pt电极上发生的是还原反应。②NiO电极的电极反应式为NO-2e-+O2-=NO2。
【考点定位】本题以氮的氧化物为载体考查物质性质、热化学反应方程式、元素周期律以及元素周期表、电化学等相关知识。
本题难度:困难
2、选择题 依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s) 设计的原电池如图所示。下列叙述正确的是??????????(??)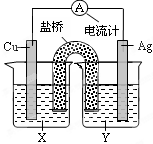
A.Y为CuSO4溶液
B.正极反应为Cu-2e- = Cu2+
C.在外电路中,电流从Cu极流向Ag极
D.将铜片浸入AgNO3溶液中发生的化学反应与该原电池
反应相同
参考答案:D
本题解析:在原电池中负极是失去电子,发生氧化反应,正极是得到电子,发生还原反应的。根据反应式可知,铜失去电子,Ag+得到电子,因此铜是负极,电解质必须含有Ag+。在原电池中电流的方向是从正极流向负极,所以正确的答案是D。
本题难度:一般
3、选择题 下列关于原电池的叙述中,正确的是
A.构成原电池的两极必须是两种不同的金属
B.原电池中发生的反应一定是氧化还原反应
C.原电池工作时总是负极溶解,正极上有物质析出
D.原电池的正极是还原剂,总是溶液中的阳离子在此被还原、
参考答案:B
本题解析:试题分析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,据此可知选项B正确。A不正确,也可以是金属与非金属;C不正确,例如燃料电池中负极不溶解;D不正确,原电池的正极不一定参与反应,溶液中的阳离子不一定在此被还原,答案选B。
考点:考查原电池原理的有关判断
点评:该题是中等难度的试题,试题设计新颖,有助于调动学生的学习兴趣,激发学生学习化学的积极性。该题基础性强,侧重对学生基础知识的巩固与训练。该题的关键是明确原电池的工作原理,然后灵活运用即可。
本题难度:一般
4、选择题 对下图所示的铜锌原电池说法不正确的是( )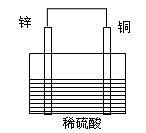
A.铜片作负极
B.锌片上发生氧化反应
C.铜片上有气泡产生
D.导线中有电流通过
参考答案:A
本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。锌比铜活泼,所以锌是负极,铜是正极,溶液中的氢离子在正极放电,所以选项A是错误的,答案选A。
本题难度:简单
5、填空题 1991年我国首创以铝-空气-海水为能源的新型“海水电池”,该电池以海水为电解质溶液,靠空气中的氧使铝不断氧化而产生电流。它比干电池能量高20~50倍。其总反应式表示为:4Al+3O2+6H2O===4Al(OH)3。
(1)该电源的负极材料为????????,(2)写出正极反应式为 :????????。
参考答案:(1)铝 ??(2) O2+2H2O+4e-===4OH-
本题解析:
试题分析:(1)原电池中,负极发生氧化反应;根据题意知,该电池以海水为电解质溶液,靠空气中的氧使铝不断氧化而产生电流,则负极材料为铝;(2)原电池工作时,正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-=4OH-。
本题难度:简单