时间:2017-01-13 08:37:50
1、选择题 下列关于甲、乙、丙、丁四幅图说法正确的是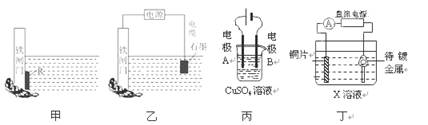
A.装置甲中对于铁闸门的保护用的是“牺牲阳极的阴极保护法”,焊接在铁闸上的金属R可以是锡块
B.装置乙中对于铁闸门的保护采用的是“外加电流的阴极保护法”,铁闸门应与直流电源的负极相连
C.装置丙可实现电解精炼铜,电极A的材料用纯铜,电极B的材料用粗铜
D.装置丁可实现镀铜,铜片接在电源的正极,待镀金属接在电源的负极,X溶液应用含有待镀金属阳离子的溶液
参考答案:B
本题解析:
试题分析:铁的活泼性强于锡的,A不正确,应该用锌快;C不正确,粗铜精炼时,粗铜做阳极,和电源的正极相连;D不正确,X溶液应用含有镀层金属阳离子的溶液,答案选B。
点评:该题是电化学的综合应用,试题基础性强,难度不大。该题的关键是明确电化学的原理,然后结合题意灵活运用即可,有助于培养学生的逻辑思维能力,提高学生灵活运用基础知识解决实际问题的能力。
本题难度:简单
2、选择题 下图所示,用石墨作电极进行电解,电解槽甲中盛AgNO3溶液,电解槽乙中盛有含二价金属G的氯化物溶液1 L,其物质的量浓度为0.1 mol·L-1,当通电一段时间后,电解槽甲中阴极增重0.27 g,乙中阴极增重0.14 g,则元素G的相对原子质量为(?? )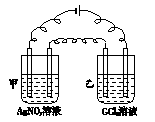 ?????????????
?????????????
A.112
B.73
C.64
D.65
参考答案:A
本题解析:本题将电解池、AgNO3溶液电解发生反应的方程式、电极反应方程式等知识点综合于一题,考查考生运用化学基本概念和基本计算的技能解决化学问题的能力。由甲池阴极发生电极反应的方程式:Ag++e- Ag↓,可求出导线上通过电子的物质的量为:n(e-)=
Ag↓,可求出导线上通过电子的物质的量为:n(e-)=本题难度:简单
3、填空题 (12分)Al及其化合物用途广泛,工业上可以将明矾石经处理后得到明矾[KAl(SO4)2·12H2O],再将明矾焙烧后制得Al2O3等物质,进一步处理后还可以得到Al。
已知焙烧明矾的化学方程式为:
请回答:
(1)Al2O3的摩尔质量是 。
(2)工业上可用电解Al2O3制备Al,其化学方程式是 。
(3)在焙烧明矾的反应中,氧化剂和还原剂的物质的量之比是 。
(4)焙烧明矾时产生的SO2可综合利用来制硫酸。
已知25℃、101 kPa时:
2SO2(g) +O2(g) 2SO3(g) △H1 = 一197 kJ/mol
2SO3(g) △H1 = 一197 kJ/mol
2H2O (g)=2H2O(1) △H2 = 一44 kJ/mol
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3 = 一545 kJ/mol
SO3(g)与H2O(l)反应的热化学方程式是 。
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液可以组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2。
①该电池的负极反应式 。
②电池总反应的化学方程式 。
参考答案:(12分)
(1) 102 g/mol &#
本题解析:
试题分析:(1)Al2O3的摩尔质量在数值等于相对分子质量,所以Al2O3的摩尔质量为:102 g/mol
(2)电解熔融的Al2O3生成Al和O2,所以化学方程式为:
(3)根据焙烧明矾的化学方程式 可知,氧化剂和还原剂的物质的量之比=6:3=2:1.
可知,氧化剂和还原剂的物质的量之比=6:3=2:1.
(4)首先写出SO3与H2O反应的化学方程式并注明状态:SO3(g)+ H2O(g) = H2SO4(l),然后根据盖斯定律计算焓变,?H=—1/2△H1+1/2△H2 +1/2△H3 =-152kJ·mol-1,故热化学方程式为:SO3(g)+ H2O(l) = H2SO4(l) △H= -152kJ·mol-1
(5)①Al为活泼金属,在负极上失去电子,所以电极方程式为:Al-3e- + 4OH-= AlO2-+2H2O
②正极上NiO(OH)得电子转化为Ni(OH)2,可得电池总反应的化学方程式为:Al+3NiO(OH)+NaOH+H2O=NaAlO2+3Ni(OH)2
考点:本题考查摩尔质量、方程式的书写、氧化还原反应、原电池原理。
本题难度:困难
4、选择题 如下图所示,a、b是多孔石墨电极,某同学按图示装置进行如下实验:断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转。下列说法不正确的是 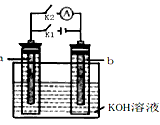 [???? ]
[???? ]
A.断开K2,闭合K1一段时间,溶液的pH要变大
B.断开K1,闭合K2时,b极上的电极反应式为: 2H++2e-= H2↑
C.断开K2,闭合K1时,a极上的电极反应式为: 4OH-―4e-= O2↑+2H2O
D.断开K1,闭合K2时,OH-向b极移动
参考答案:B
本题解析:
本题难度:一般
5、选择题 市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。这种锂离子电池的电池反应式为:
Li+2Li0.35NiO2 2Li0.85NiO2。下列说法不正确的是 [???? ]
2Li0.85NiO2。下列说法不正确的是 [???? ]
A.放电时,负极的电极反应式:Li-e-==Li+
B.充电时,Li0.85NiO2既发生氧化反应又发生还原反应
C.该电池不能用水溶液作为电解质
D.放电过程中Li+向负极移动
参考答案:D
本题解析:
本题难度:一般