时间:2017-01-13 08:37:30
1、选择题 下列图示与对应的叙述相符的是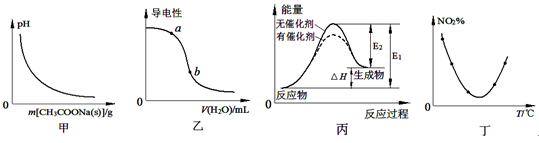
A.图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
B.图乙表示向CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b
C.图丙表示催化剂能改变化学反应的焓变
D.图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g) N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
参考答案:D
本题解析:
试题分析:A、向醋酸溶液中加入醋酸钠固体后,则溶液中的醋酸根离子浓度增大,醋酸的电离平衡逆向移动,则溶液的氢离子浓度减小,pH增大,错误;B、向醋酸溶液中加水稀释,则溶液中的离子浓度减小,导电能力减弱,所以a点的氢离子浓度大于b点,则CH3COOH溶液的pH:a<b,错误;C、催化剂只能改变反应的活化能,不能改变反应热,错误;D、根据丁图可知,曲线的最低点为开始达到平衡时二氧化氮的含量,再升高温度,则二氧化氮的含量增大,说明升高温度,平衡逆向移动,则正反应是放热反应,△H<0,正确,答案选D。
考点:考查对图像的分析,化学平衡移动的判断
本题难度:一般
2、选择题 下列事实可证明氨水是弱碱的是( )
A.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
B.铵盐受热易分解
C.0.1mol/L氨水可以使酚酞试液变红
D.室温下,0.1mol/L氨水溶液的pH约为11
参考答案:D
本题解析:
本题难度:一般
3、选择题 下列说法正确的是
A.在CuSO4溶液中加入PbS,可转变为铜蓝(CuS),则Ksp(PbS)<Ksp(CuS)
B.在NaHS溶液中,加入少量CuCl2粉末产生黑色沉淀,则pH增大
C.加热条件下并加入大量水促进TiCl4水解,以制备TiO2固体
D.铜制器皿放置过程中会生成铜绿是因为发生了析氢腐蚀
参考答案:C
本题解析:
试题分析:A.在CuSO4溶液中加入PbS,可转变为铜蓝(CuS),是因为难溶的向更难溶的转化。则Ksp(PbS)>Ksp(CuS)。错误。B.在NaHS溶液中,存在电离平衡:HS- H++S2-,当向其中加入少量CuCl2粉末时,发生反应:Cu2++S2-=CuS↓产生黑色沉淀,由于消耗了S2-,
H++S2-,当向其中加入少量CuCl2粉末时,发生反应:Cu2++S2-=CuS↓产生黑色沉淀,由于消耗了S2-,
本题难度:一般
4、填空题 (14分)现有常温下的六份溶液:
① 0.01 mol/L CH3COOH溶液;
②0.01 mol/L HCl溶液;
③pH=12的氨水;
④pH=12的NaOH溶液;
⑤0.01 mol/L CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;
⑥0.01 mol/L HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)其中水的电离程度最大的是_____(填序号,下同),水的电离程度相同的是______。
(2)将六份溶液同等稀释10倍后,溶液的pH:
①________②,③________④,⑤________⑥(填“>”、“<”或“=”)。
(3)0.020 mol/L的HCN(aq)与0.020 mol/L NaCN(aq)等体积混合,已知该混合溶液中c (Na+) > c( CN-),用“>、<、=”符号填空
①溶液中c (OH-) c (H+)
②c (HCN) c (CN-)
(4)在25mL 0.1 mol·L-1的NaOH溶液中逐滴加入0.2 mol·L-1的CH3COOH溶液,溶液pH变化曲线如图所示。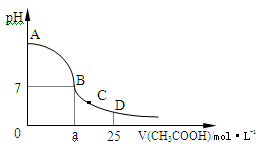
①B点溶液呈中性,有人据此认为,在B点时NaOH溶液与CH3COOH溶液恰好完全反应,这种看法是否正确?
(填“是”或“否”),如果不正确,则二者恰好完全反应的点是在 (填“AB”、“BC”或“CD”)区间内。
②在C点,溶液中离子浓度由大到小的顺序为: 。
参考答案:(1)⑥,②③④ ;(2)> >&#
本题解析:
试题分析:(1)①②③④是酸或碱对水的电离起抑制作用,⑤NH3·H2O是弱碱,CH3COOH是弱酸,反应后溶液中溶质:CH3COONH4、NH3·H2O,对水的电离抑制,⑥两者恰好完全反应,生成NaCl,对水的电离无影响,所以⑥的水的电离最大,②③④溶液中c(H+)或c(OH-)相等,对水的电离影响相同;(2)①CH3COOH是弱酸,②HCl是强酸,稀释相同倍数,醋酸中的c(H+)小于盐酸中c(H+),pH:①>②;pH=12时,NH3·H2O是弱碱在稀释过程还要电离出一部分OH-,c(OH-)大于氢氧化钠溶液中c(OH-),③>④;⑤反应后溶液显碱性,⑥反应后溶液显中性,⑤>⑥;(3)混合溶液中c(Na+)>c(CN-),说明CN-的水解大HCN的电离,溶液显碱性,①c(OH-)>c(H+),②c(HCN)>c(CN-);(4)①醋酸是弱酸,氢氧化钠是强碱,两者恰好完全反应生成的CH3COONa是强碱弱酸盐,水溶液显碱性,因此这种看法不正确,填写:否,二者恰好完全反应的点在AB区间内;②在C点溶液显酸性,此时的溶质是:CH3COOH、CH3COONa,CH3COOH的电离大于CH3COO-的水解,因此离子浓度由大到小的顺序:c(CH3COO-)> c(Na+)> c(H+)> c(OH-)。
考点:考查弱电解质的电离、离子浓度大小等知识。
本题难度:困难
5、填空题 (10分)最近雾霾天气肆虐我国大部分地区,其中SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2。
(1)钠碱循环法中,吸收液为Na2SO3溶液,该反应的离子方程式是 。
(2)已知H2SO3的电离常数为K1=1.54×10-2,K2=1.024×10-7,H2CO3的电离常数为K1=4.30×10-7,K2=15.60×10-11,则下列微粒可以大量共存的是 (填序号)
A.CO32- 、HSO3- B.HSO3-、HCO3- C.SO32- 、HCO3- D.HCO3-、H2SO3
(3)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 ①根据上表判断NaHSO3溶液显 性,试解释原因 ②在NaHSO3溶液中离子浓度关系不正确的是 A.c(Na+)=2c(SO32-)+c(HSO3-) B.c(H2SO3)+c(H+)= c(SO32-)+c(OH-) C.c(Na+)> c(HSO3-)> c(H+)> c(SO32-)> c(OH-) D.c(H+)+ c(Na+)=2c(SO32-)+c(HSO3-)+ c(OH-) 参考答案:(1)SO32-+SO2+H2O=2HSO3-;(2)B、C 本题解析: 本题难度:困难 |