时间:2017-01-13 08:05:08
1、填空题 有A、B、C、D、E五种短周期元素,已知相邻的A、 B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2。E的阳离子与A的阴离子核外电子层结构完全相同。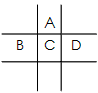
回答下列问题:
(1)五种元素的名称:A______,B______, C______,D______,E______。
(2)B、C、D元素的原子半径由大到小的顺序为__________________________,它们的最高价氧化物对应水化物的酸性强弱顺序为_________________________。
(3)写出C单质在足量A单质中燃烧后的产物与D单质同时通入水中的化学方程式__________________。
(4)A与E形成的化合物的化学式是________,它的性质决定了它在物质的分类中应属于____________。
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量时,观察到的现象是__________________,有关反应的离子方程式为_________________________。
参考答案:(1)?氧;磷;硫;氯;铝
(2)r(P)>
本题解析:
本题难度:困难
2、填空题 有A、B、C、D、E五种元素,它们可能是原子或离子,且为短周期元素,A与B可形成BA型化合物,且A元素是非金属性最强的元素,金属B的原子核内质子数比它前一周期同主族元素原子的质子数多8个;C元素有三种同位素C1、C2、C3,自然界里含量最多的是C1,C3原子的质量数是C1的3倍,C2原子的质量数是C1的2倍。D的气态氢化物水溶液显碱性,而其最高价氧化物水化物为强酸,E元素原子的最外层电子数比次外层电子数多4个。
(1)写出各元素的符号:A________,B______,C______,D______,E______。
(2)写出C1、C2、C3粒子的符号:__________、__________、_______ 。
(3)E的氢化物的分子式______________。
(4)写出A的单质、B的单质分别与水反应的化学方程式___________________________ 、__________________________________,将反应后生成的溶液混合,发生反应的离子方程式为:____________________________。
参考答案:(1)氟;钠;氢;氮;氧
(2)11H;21H(D);
本题解析:
本题难度:一般
3、推断题 已知:A、B、C、E四种短周期元素,A是原子半径最小的元素,B元素基态原子的2P轨道上只有两个电子,?C元素的基态原子L层只有2对成对电子,E元素在第三周期元素中电负性最大。D元素的化合物D3C4具有磁性。
(1)分子式为BC2的空间构型为___________;E元素原子的电子排布式为____________。
(2)?某直线形分子由A、B两种元素组成且原子个数比为1:1,该分子中含有________个σ键,?___________个π键;?其中心原子的杂化类型为____________。
(3)同质量的A2C晶体的密度小于液体(4℃时)的密度,其原因是____________。
(4)若向由A、C组成某种化合物的稀溶液中加入少量二氧化锰,有无色气体生成。则该化合物的分子式是__________?,属于___________分子(填:“极性”或“非极性”),该反应的化学方程式是____________________。
(5)①?D与水蒸气反应的化学方程式为_____________;???
②?已知D(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断D(CO)5晶体属于_____________(填晶体类型)。
参考答案:(1)直线型;1S22S22P63S23P5或[Ne] 3S
本题解析:
本题难度:一般
4、简答题 I.如图是由Emil?Zmaczynski设计的金字塔式元素周期表的一部分,图上标有第ⅥA族和几种元素的位置.请回答下列问题: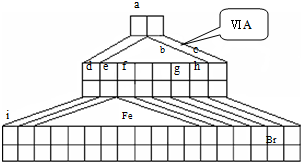
(1)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是:氢的最外层电子“饱和缺一”.请写出NaH的电子式______.
(2)Fe的周期位置______
(3)用电子式表示元素a、g形成化合物的形成过程______;
(4)写出b元素的氢化物与b元素的最高价氧化物对应水化物反应的化学方程式______
(5)d的最高价氧化物对应的水化物与f的单质反应的离子方程式______.
(6)a元素与碳元素形成分子的空间结构可能是(填序号)______.
(7)请设计实验比较e?f?的金属性强弱(要求有操作、现象、结论)______.
(8)d的某化合物呈淡黄色,可与氯化亚铁溶液反应生成红褐色沉淀和某气体,若沉淀和气体的物质的量之比为2:1,反应的离子方程式为______.
参考答案:(1)把H放在第ⅦA族,则H元素的最低化合价为-1价,则Na
本题解析:
本题难度:一般
5、选择题 下列递变规律正确的是
A.热稳定性:HCl>HF>H2O
B.元素的最高正化合价:F>S>C>K
C.碱性:NaOH>Mg(OH)2>Ca(OH)2
D.沸点:金刚石>硫>水>氮气
参考答案:D
本题解析:非金属性越强,相应氢化物的稳定性就越强,非金属性是F>O>Cl,A不正确。氟是最强的非金属,没有正价,B不正确。金属性越强,最高价氧化物的水化物的解析就越强,金属性是Ca>Na>Mg,C不正确。金刚石是原子晶体,所以沸点最高,因此选项D正确,答案选D。
本题难度:简单