时间:2017-01-13 07:55:58
1、选择题
A.c(CH3COO-)>c(Na+)
B.c(CH3COOH)>c(CH3COO-)
C.2c(H+)=c(CH3COO-)-c(CH3COOH)
D.c(CH3COOH)+c(CH3COO-)=0.01 mol·L-1
参考答案:AD
本题解析:将0.02 mol·L-1 CH3COOH和0.01 mol·L-1NaOH等体积混合后,混合液的溶质为CH3COOH和CH3COONa,且等物质的量。由于CH3COOH的电离趋势大于CH3COO-的水解趋势,所以,c(CH3COO-)>c(Na+);但无论怎么变化,由物料守恒知:c(CH3COOH)+c(CH3COO-)=0.01 mol·L-1。
本题难度:简单
2、选择题 在试管中注入某浅红色溶液,给试管加热,溶液红色加深。则原溶液可能是 [???? ]
①滴有石蕊的H2SO4溶液
②滴有石蕊的NH4Cl溶液
③滴有酚酞的氨水溶液
④滴有酚酞的Na2CO3溶液
A.①②
B.③④
C.①③
D.②④
参考答案:D
本题解析:
本题难度:一般
3、选择题 下列说法正确的是 [???? ]
A.在纯水中加入硫酸会抑制水的电离,加醋酸会促进水的电离
B.常温下,0.1?mol/L氯化铵溶液加水稀释,溶液中的c(OH–)增大
C.1?mL?pH?=?2?的醋酸溶液加水稀释到10?mL,pH变为3
D.常温下,Na2CO3溶液加水稀释,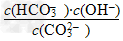 增大
增大
参考答案:B
本题解析:
本题难度:一般
4、选择题 常温下,下列溶液中的微粒浓度关系正确的是(??)
A.新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-)
B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
C.pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+) >c(OH-)=c(H+)
D.0.2mol·L-1CH3COOH溶液与0.1mol·L-1NaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
参考答案:D
本题解析:
试题分析:A、新制氯水中加入固体NaOH所以生成次氯酸钠、氯化钠、水:溶液中存在电荷守恒c(H+)+c(Na+)=c(Cl﹣)+c(ClO﹣)+c(OH﹣),故A错误;B、碳酸氢钠溶液中碳酸氢根离子水解大于电离;pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3﹣)>c(H2CO3)>c(CO32﹣),故B错误;C、氨水存在电离平衡盐酸反应完全,一水合氨又电离出氢氧根离子和铵根离子,溶液呈碱性溶液中离子浓度大小为:c(NH4+)>c(Cl﹣)>c(OH﹣)>c(H+);故C错误;D、0.2
本题难度:一般
5、填空题 (12分)化学实验室通常用粗锌和稀硫酸反应制氢气,因此在制氢废液中含有大量的硫酸锌。同时,由于粗锌中还含有铁等杂质,使得溶液中混有一定量的硫酸亚铁,为了充分利用制氢废液,常用其制备皓矾(ZnSO4·7H2O)。某校化学兴趣小组的同学以制氢气的废液为原料来制取皓矾并探究其性质。  (l)制备皓矾的实验流程如下图所示。
(l)制备皓矾的实验流程如下图所示。
已知:下列氢氧化物开始生成沉淀到沉淀完全的pH范围分别为:
| ? | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Zn(OH)2 | 5.7 | 8.0 回答下列问题: 可供选择使用的有:氯水、20%的H2O2、氨水、NaOH溶液、Zn(OH)2、ZnO ① 加入的试剂①,应选用????????,作用:????????????????????????????????。 ② 加入的试剂②调节pH,可选用??????????或?????????,用离子方程式表示其原理 ?????????????????????????????????????????????????????????????????。 ③有同学提出,应将晶体1加入稀硫酸中溶解,原因是??????????????????。 ④在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是???????????????????。 (2)检验皓矾中是否含有Fe元素的操作(试剂自选)????????????????????????。 参考答案:(l)① 20%的H2O2(1分);Fe2+氧化为Fe3+, 本题解析: 本题难度:困难 |