时间:2017-01-13 07:46:09
1、填空题 硫化钠是重要的工业原料。
(1)高温时,等物质的量甲烷与硫酸钠在催化剂作用下恰好完全反应,制得硫化钠。反应的化学方程式为__________________。
(2)甲同学往某Na2S样品(含Na2CO3、Na2SO4杂质)溶液中加人少量BaS溶液,产生白色沉淀,过滤,向滤渣中加人过量盐酸,沉淀完全溶解。由此得出结论:相同温度下,Ksp(BaCO3)<Ksp(BaSO4)。
①沉淀溶于盐酸的离子方程式是__________________。
②仅由上述实验无法判断Ksp(BaCO3)与Ksp(BaSO4)的大小关系,理由是______。
(3)利用Na2S为沉淀剂由锌灰可制得ZnS。锌灰经稀硫酸浸取后所得浸取液含Zn2+、Cd2+、Al3+、Fe2+, Fe3+等,由该浸取液制备ZnS的工艺流程如下图所示。
①步骤(i)所得滤渣中含有铝元素的物质为______(填化学式)。
②步骤(ii)所加ZnO的作用为____________。
③步骤(iii)中得到Cd单质的离子方程式为____________。
参考答案:(15分)
(1)CH4+Na2SO4
本题解析:
试题分析:(1)、硫酸钠变为硫化钠时,硫元素由+6价降为—2价,由此推断甲烷中碳元素的化合价升高,由—4价升为+4价,生成CO2,根据最小公倍数法配平可得反应式CH4+Na2SO4 Na2S+CO2+2H2O;(2)、Na2CO3、Na2SO4与BaS溶液均能反应生成白色的沉淀,但是BaCO3能溶于盐酸,
Na2S+CO2+2H2O;(2)、Na2CO3、Na2SO4与BaS溶液均能反应生成白色的沉淀,但是BaCO3能溶于盐酸,
本题难度:困难
2、选择题 下列物质不能溶于浓氨水的是
A.AgCl
B.Cu(OH)2
C.AgOH
D.Fe(OH)3
参考答案:D
本题解析:AC项均可和氨水反应生成络合物:Ag(NH3)2+,而B项可生成Cu(NH3)42+,故答案为D
本题难度:一般
3、填空题 工业上以黄铜矿(主要成分是CuFeS2,杂质不溶于水和酸)为原料,制备蓝色晶体G,其化学式为[Cu(NH3)4]SO4·H2O,涉及流程如下: 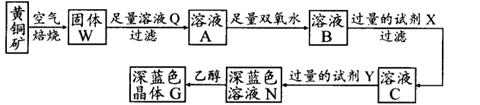
已知25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表: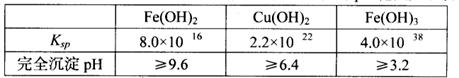
(1)黄铜矿在空气中焙烧能生成铁和铜的低价硫化物,写出其反应的化学方程式: ;
(2)试剂X的化学式为 ;
(3)常温下,0.1 mol/L试剂Y的pH=11,则该温度下,试剂Y的电离常数为 ,用pH试纸测该溶液pH值的方法是 ;
(4)在溶液N中加入乙醇的目的是 。
参考答案:(1)2CuFeS2+O2本题解析:
试题分析:(1)黄铜矿在空气中焙烧能生成铁和铜的低价硫化物,即Cu2S和2FeS,由S元素守恒,S元素有多余,与O2结合为SO2。(2)B溶液含Cu2+和Fe3+,为了除去Fe3+,可以降低溶液的pH至3.2到6.4之间,试剂X的化学式为CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3等;(3)试剂Y是氨水,0.1 mol/L时pH=11,c(OH-)≈c(NH4+)=10-3;NH3·H2O的电离常数为K=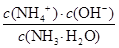 =10-5;(4)用pH试纸测该溶液pH值的方法是用洁净的玻璃棒蘸取待测液点在pH试纸的中央,并与比色卡比色;(4)在溶液N中加入乙醇的目的是降低晶体溶解度,有利于晶体析出。
=10-5;(4)用pH试纸测该溶液pH值的方法是用洁净的玻璃棒蘸取待测液点在pH试纸的中央,并与比色卡比色;(4)在溶液N中加入乙醇的目的是降低晶体溶解度,有利于晶体析出。
考点:化学方程式的书写即实验基本操作。
本题难度:困难
4、填空题 在一固定容积的密闭容器中进行着如下反应:
CO2(g) + H2(g)? ??CO(g) + H2O(g),其平衡常数K和温度t的关系如下:
??CO(g) + H2O(g),其平衡常数K和温度t的关系如下:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 (1) K的表达式为: ????????? ?? ;该反应的正反应为 ???????? 反应(“吸热”或“放热”) (2) 能判断该反应是否已经达到化学平衡状态的是:??????????????? A.容器中压强不变 ??????B.混合气体中CO浓度不变 C.v(H2)正= v(H2O)逆 ??? D.c(CO2) = c(CO) (3)某研究小组利用反应:CO(g)+H2O(g)  ?H2(g)+CO2(g) ?△H=-41.2kJ/mol,制备CO2与H2的混合气体。用碱液吸收一定量CO2的方法来提高混合气中H2与CO2的体积比。若以1L1.5mol/L的NaOH溶液充分吸收了22.4L(已折算为标准状况下体积)CO2,则吸收后溶液中各离子浓度从大到小的顺序是????????????????????????????????。 ?H2(g)+CO2(g) ?△H=-41.2kJ/mol,制备CO2与H2的混合气体。用碱液吸收一定量CO2的方法来提高混合气中H2与CO2的体积比。若以1L1.5mol/L的NaOH溶液充分吸收了22.4L(已折算为标准状况下体积)CO2,则吸收后溶液中各离子浓度从大到小的顺序是????????????????????????????????。(4)如将H2与CO2以4:1的体积比混合,在适当的条件下可制得CH4。已知: CH4 (g) + 2O2(g)  ?CO2(g)+ 2H2O(1)??ΔH1=-890.3 kJ/mol? ?CO2(g)+ 2H2O(1)??ΔH1=-890.3 kJ/mol?H2(g) + 1/2O2(g)  ?H2O(1)???????????ΔH2=-285.8 kJ/mol? ?H2O(1)???????????ΔH2=-285.8 kJ/mol?则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是?????????????????????。 (5)熔融盐燃料电池如下图:  该图是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。已知负极的电极反应是CH4 +4CO32--8e-=5CO2+2H2O。正极的电极反应是_______?。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环,则A物质的化学式是_________。实验过程中,若通入了标准状况下空气448L(假设空气中O2体积分数为20%),则熔融盐燃料电池消耗标准状况下CH4____________L。 参考答案:(1) 本题难度:一般 5、选择题 常温时,将等质量的AgCl固体分别加入到等体积的下列4种溶液中,AgCl溶解最少的是 参考答案:A 本题解析: 本题难度:一般 |