时间:2017-01-12 20:17:38
1、选择题 已知2FeCl3?+?2KI?=?2FeCl2?+?2KCl?+?I2,H2S?+?I2?=?2HI?+?S,下列叙述正确的是[???? ]
A.?氧化性:Fe3+>I2>S?????????????????
B.?氧化性:I2>S>Fe3+
C.?还原性:Fe2+>I->H2S???????????????????
D.?还原性:Fe2+>H2S>I-
参考答案:A
本题解析:
本题难度:一般
2、选择题 在常温下,发生下列几种反应??2KMnO4+ 16HCl = 2KCl + 2MnCl2+ 5Cl2↑ +8H2O
?Cl2 + 2NaBr = 2NaCl + Br2???????????Br2+ 2FeBr2?= 2FeBr3
根据上述反应,下列结论正确的是
A.还原性强弱顺序为:Br—>Fe2+>Cl—
B.氧化性强弱顺序为:MnO4—>Cl2>Br2>Fe3+
C.反应?中,当生成1molCl2时,被氧化的HCl为3.2mol
D.溶液中可发生反应:2Fe3+ + 2Cl—= 2Fe2+ + Cl2↑
参考答案:B
本题解析:略
本题难度:简单
3、选择题 氢化钠(NaH)是一种生氢剂,可发生如下反应:NaH+H2O = NaOH+H2↑对这一反应的描述正确的是(???)
A.NaH是氧化剂
B.NaH是氧化产物
C.NaOH是还原产物
D.氧化产物与还原产物的质量比是1:1
参考答案:D
本题解析:
试题分析:根据反应的化学方程式可知,NaH中氢元素的化合价是-1价的,反应后升高到0价,失去1个电子。水中氢元素的化合价从+1价降低到0价,得到1个电子,所以氢化钠是还原剂,水是氧化剂,氢气既是氧化产物,也是还原产物,答案选D。
点评:该题是中等难度的试题,试题基础性强,侧重能力的培养。该题的关键是准确标出有关元素的化合价变化情况,然后根据氧化还原反应的有关概念灵活运用即可。
本题难度:简单
4、选择题 向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示。有关说法不正确的是(? )
A.线段BC代表Fe3+物质的量的变化情况
B.原混合溶液中c(FeBr2)=6 mol·L-1
C.当通入Cl22 mol时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
D.原溶液中n(Fe2+):n(I-):n(Br-)=2:1:3
参考答案:B
本题解析:离子还原性顺序:I->Fe2+>Br-,由图可知,当Cl2通入1 mol时,与I-反应,1~3 mol时,Cl2与Fe2+反应,3~6 mol时,Cl2与Br-反应,由2Br-+Cl2=Br2+2Cl-知n(Br-)=6 mol,因不知溶液体积,故不能确定溶液中FeBr2的浓度。
本题难度:一般
5、选择题 向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。有关说法不正确的是( )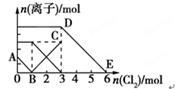
A.线段BC代表Fe3+物质的量的变化情况
B.原混合溶液中n(FeBr2)=3mol
C.当通入2molCl2时,溶液中已发生的离子反应为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
D.原溶液中n(Fe2+):n(I-):n(Br-)=2∶1∶3
参考答案:B
本题解析:
试题分析:还原性为I->Fe2+>Br-,则先发生2I-+Cl2
本题难度:一般