时间:2017-01-12 20:10:07
1、选择题 如图,A池用石墨电极电解NaOH溶液,B池精炼粗铜,一段时间后停止通电,A池中d极产生具有氧化性的气体在标准状况下为2.24L.下列说法正确的是( )
A.A池为电解池,B池为原电池
B.d、e两极都发生氧化反应
C.e极应为粗铜板材料
D.B池中e极质量增加12.8g
参考答案:A池用石墨电极电解NaOH溶液,B池精炼粗铜,一段时间后停止
本题解析:
本题难度:简单
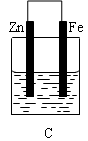
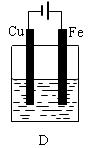
2、填空题 某实验小组用以下几个实验装置探究电化学过程对金属与稀硫酸反应速率的影响, 烧杯中都盛有稀H2SO4。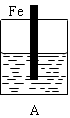

试回答:
(1)B装置中Cu电极上的电极反应式为?????,D装置中Fe电极上的电极反应式为?????????。
(2)D装置中的实验现象有?????????????????????????????????,若用电流表测量反应时通过导线的电子流量为0.2mol,则Fe电极的质量变化为???????????????。
(3)B、C两个装置中Fe片被腐蚀的速率更快的是????(填B或C)。
参考答案:(1) 2H++2e-=H2 ↑,Fe-2e-=Fe2+。<
本题解析:
试题分析:(1)在B装置中由于活动性Fe>Cu,所以Cu电极为原电池的正极,在正极上的电极反应式为2H++2e-=H2↑,D装置为电解池。由于在D装置中Fe电极与直流电源的正极相连接,所以为阳极。在Fe电极上的发生氧化反应,电极反应式为Fe-2e-=Fe2+。(2)在D装置中可看到的实验现象有Fe电极逐渐溶解消耗,在Cu电极上不断有气泡产生。同时溶液逐渐由无色变为浅绿色。若用电流表测量反应时通过导线的电子流量为0.2mol,因为Fe是+2价的金属,则Fe电极消耗的物质的量为0.1mol,由于Fed
本题难度:一般
3、填空题 (16分)
Ⅰ、工业上用含有Cr2O72-和CrO42-的废水回收铬。其工艺流程如下:
已知:①2 CrO42-(黄色)+2H+  Cr2O72-(橙色)+ H2O;
Cr2O72-(橙色)+ H2O;
②常温下,Ksp【Fe(OH)3】=1.0×10-38,Ksp【Cr(OH)3】=1.0×10-32;
③当离子浓度小于1.0×10-5mol·L-1时,认为沉淀完全。
(1)下列选项中能说明反应2 CrO42-(黄色)+2H+  Cr2O72-(橙色)+ H2O达平衡状态的是_______(填选项字母)。
Cr2O72-(橙色)+ H2O达平衡状态的是_______(填选项字母)。
A.Cr2O72-和CrO42-的浓度相同
B.2v(Cr2O72-)= v(CrO42-)
C.溶液的颜色不变
D.溶液的PH不变
(2)为防止FeSO4溶液变质,在保存时需加入的试剂为 (填试剂名称)
(3)过滤操作中需要用到的玻璃仪器有
(4)FeSO4溶液与溶液A发生反应的离子方程式为
(5)沉淀C的化学式为 ,pH2的范围为
Ⅱ、铝电池性能优越,铝一空气电池以其环保、安全而受到越来越多的关注,其原理如图所示。
(6)该电池的总反应化学方程式为 ;
(7)某铝一空气电池的效率为50%,若用其作电源电解500mL的饱和NaCl溶液,电解结束后,所得溶液(假设溶液电解前后体积不变)中NaOH的浓度为0.3 mol·L-1,则该过程中消耗铝的质量为 。
参考答案:(1)cd(各1分,共2分)
(2)铁粉 硫酸 (各1
本题解析:
试题分析:
(1)2 CrO42-(黄色)+2H+  Cr2O72-(橙色)+ H2O达平衡状态时A.物质的平衡溶液与起始浓度与反应进行的程度有关,Cr2O72-和CrO42-的平衡浓度相同,不能判断是否达到平衡,故A错误。
Cr2O72-(橙色)+ H2O达平衡状态时A.物质的平衡溶液与起始浓度与反应进行的程度有关,Cr2O72-和CrO42-的平衡浓度相同,不能判断是否达到平衡,故A错误。
B. 2v(Cr2O72-)= v(CrO42-),没体现出正反应速率等于逆反应速率,不能判断是否平衡,故B错误。C.溶液的颜色不变,说明物质的浓度不再变化,说明反应达平衡状态。故C正确。D.溶液的pH不变,说明H+浓度不变,化学反应达平衡状态。故D正确。(2)为防止FeSO4溶液变质,在保存时需加入的试剂为铁粉防止氧化,加入硫酸防止亚铁离子水解变浑。(3)过滤操作中需要用到的玻璃仪器有烧杯 漏斗 玻璃棒 。(4)已知工业废水中含有和CrO42-在酸化过程中CrO42-转化为Cr2O72-,所以加入的FeSO4溶液与Cr2O72-溶液发生反应的离子方程式为r2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O 。(5)已知常温下,Ksp【Fe(OH)3】=1.0×10-38<Ksp【Cr(OH)3】=1.0×10-32;调节pH1使Fe3+生成Fe(OH)3沉淀而析出,调节pH2目的是使Cr3+转化为Cr(OH)3而析出。由C(Cr3+)c3(OH-)=1×10-32,当Cr3+沉淀完全时
c3(OH-)=1×10-32/C(Cr3+)=1×10-32/1.0×10-5 =1×10-27
c(OH-)=1×10-9,pH=5,pH2的范围为pH2>5.
Ⅱ、(6)铝一空气电池的总反应化学方程式为4Al+3O2+6H2O=4Al(OH)3;(7)某铝一空气电池的效率为50%,若用其作电源电解500mL的饱和NaCl溶液,电解结束后,所得溶液(假设溶液电解前后体积不变)中NaOH的浓度为0.3 mol·L-1,则生成NaOH的物质的量为0.15 mol。由原电池反应方程式与电解总方程式可得关系式:
Al----3e----3NaOH
27g 3mol
m(Al)×50% 0.15mol
解得: m(Al)=2.7g
考点:了解化学平衡建立的过程。理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,认识并能用相关理论解释其一般规律。 了解难溶电解质的沉淀溶解平衡。了解溶度积的含义及其表达式,能进行相关的计算。解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。
点评:本题考查:化学平衡状态的判断依据:(1)速率判据:v正=v逆。(2)浓度判据:反应体系各物质的浓度(及与浓度相关的量如颜色、气体压强等)不再变化。熟练应用Ksp求算分离或除去某离子时的pH范围。电化学装置中的相关计算常采用电子守恒的方法。
本题难度:困难
4、简答题 由碳棒、铁片和200mL稀H2SO4(足量)组成的原电池中,当在碳棒上共放出3.36L(标准状况)气体时,求消耗铁多少克?有多少个电子通过了导线?
参考答案:设需要消耗铁x.
该原电池的电池反应式为:
??
本题解析:
本题难度:一般
5、填空题 [化学—选修2:化学与技术](15分)
锌锰电池(俗称干电池)在生活中的用量很大。两种锌锰电池的构造图如图(a)所示。
回答下列问题:
(1)①普通锌锰电池放电时发生的主要反应为:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH。该电池中,负极材料主要是____________________,电解质的主要成分是__________,正极发生的主要反应是________________________________________________________。
②与普通锌锰电池相比,碱性锌锰电池的优点及其理由是_______。
(2)图(b)表示回收利用废旧普通锌锰电池的一种工艺(不考虑废旧电池中实际存在的少量其他金属)。
①图(b)中产物的化学式分别为A_______,B________。
②操作a中得到熔块的主要成分是K2MnO4。操作b中,绿色的K2MnO4溶液反应后生成紫色溶液和一种黑褐色固体,该反应的离子方程式为_______。
③采用惰性电极电解K2MnO4溶液也能得到化合物D,则阴极处得到的主要物质是____。(填化学式)
参考答案:
(1)①Zn??? NH4Cl?? MnO2+NH4
本题解析:
(1)根据化学方程式Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH,锌是负极材料,氯化铵是电解质的主要成分,二氧化锰和铵根离子在正极发生反应, MnO2+NH4++e-=" MnOOH+" NH3。与普通锌锰电池相比,碱性锌锰电池的优点及其理由是碱性电池不易发生电解质的泄露,因为消耗的负极改装在电池的内部,碱性电池的使用寿命较长,因为金属材料在碱性电解质中比在酸性电解质中的稳定性提高。
(2)废电池经机械分离后,加水溶解后再加稀盐酸,浓缩结晶得到氯化铵和氯化锌。氯化铵不
本题难度:一般