时间:2017-01-12 19:31:58
1、选择题 设NA为阿伏伽德罗常数的值.下列叙述正确的是
A.25℃,PH=13的NaOH溶液中含有OHˉ的数目为0.1NA
B.1?mol乙醇中含有C-H键的数目为5NA
C.1?mol?Cl2与足量的铁反应,转移的电子数为3NA
D.10L?pH=1的硫酸溶液中含有的H+离子数为2NA
参考答案:B
本题解析:分析:A、溶液体积不知,不能计算微粒数;
B、依据乙醇分子结构分析计算;
C、氯气和铁反应生成氯化铁,电子转移依据氯气计算;
D、硫酸溶液中含有的氢离子包括硫酸电离生成,水电离生成.
解答:A、溶液体积不知,PH=13的NaOH溶液中含有OHˉ的数目不能计算,故A错误;
B、乙醇结构简式CH3CH2OH,可知1 mol乙醇中含有C-H键的数目为5NA,故B正确;
C、1 mol Cl2与足量的铁反应生成氯化铁,电子转移依据氯气计算,转移的电子数为2NA,故C错误;
D、10L pH=1的硫酸溶液中,氢离子包括硫酸电离生成,水电离生成,含有的H+离子数大于2NA,故D错误;
故选B.
点评:本题考查了阿伏伽德罗常数的应用,主要考查微粒数的计算方法,物质结构计算化学键,氧化还原反应电子转移,电解质溶液中离子分析判断,题目难度中等.
本题难度:一般
2、选择题 在同温同压下,关于等质量的CO2和SO2气体,下列说法不正确的是
A.CO2和SO2的分子数比为16:11
B.CO2和SO2的物质的量相同
C.CO2和SO2的体积比为16:11
D.CO2和SO2的密度比为11:16
参考答案:B
本题解析:分析:同温同压下,气体的Vm相等,根据n=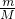 =
=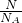 =
= 计算相关物理量.
计算相关物理量.
解答:A.N(CO2)=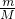 ×NA=
×NA=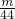 NA,N(SO2)=
NA,N(SO2)=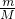 ×NA=
×NA=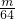 NA,二者的分子数比为64:44=16:11,故A正确;
NA,二者的分子数比为64:44=16:11,故A正确;
B.n(CO2)=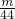 mol,n(SO2)=
mol,n(SO2)=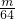 mol,二者的物质的量不同,故B错误;
mol,二者的物质的量不同,故B错误;
C.由n=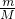 =
= 可知,同温同压下,等质量的两种气体的体积之比与摩尔质量呈反比,为64:44=16:11,故C正确;
可知,同温同压下,等质量的两种气体的体积之比与摩尔质量呈反比,为64:44=16:11,故C正确;
D.由ρ=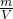 =
=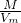 可知,二者的密度之比与摩尔质量呈正比,为44:64=11:16,故D正确.
可知,二者的密度之比与摩尔质量呈正比,为44:64=11:16,故D正确.
故选B.
点评:本题考查阿伏加德罗定律及其推论,题目难度不大,注意把握相关计算公式的推导及应用.
本题难度:一般
3、选择题 下列粒子属等电子体的是
A.NO和O2
B.CH4和NH4+
C.NH2?和H2O2
D.HCl和H2O
参考答案:B
本题解析:试题分析:原子数和电子数分别都相等的是等电子体,A中电子数不同,C、D中原子数和电子数分别都不同,答案选B。
考点:考查等电子体的判断
点评:该题是基础性试题的考查,试题注重基础,兼顾能力的培养。该题的关键是明确等电子体的含义,难度不大,学生不难得分。
本题难度:简单
4、选择题 下列物质既能导电又属电解质的是:
A.硝酸钾溶液
B.无水硫酸铜晶体
C.熔融的氯化钠
D.无水乙醇
参考答案:C
本题解析:试题分析:在溶液中或在熔融状态下能导电的化合物是电解质,在溶液中和在熔融状态下都不能导电的化合物是非电解质,所以硫酸铜和氯化钠是电解质,乙醇是非电解质。但硫酸铜晶体不能导电,熔融的氯化钠可以导电。硝酸钾溶液可以导电,但属于混合物,答案选C。
考点:考查电解质的有关判断
点评:本题是高考中的常见考点之一,主要是检验学生对化学基本概念的理解掌握程度,特别是概念的内涵和外延,有利于培养学生严谨的思维方式。
本题难度:一般
5、选择题 在某100mL混合液中,HNO3和H2SO4的物质的量浓度分别是0.30mol·L-1和0.15mol·L-1。向该混合液中加入3.20g铜粉,加热,待充分反应后,所得溶液中的Cu2+的物质的量浓度(mol·L-1)是
A.0.225
B.0.25
C.0.45
D.0.50
参考答案:A
本题解析:反应的离子方程式为3Cu+2NO3-+8H+=3Cu2+4+H2O+2NO↑,溶液中NO3-和H+的物质的量分别为0.03mol和0.06mol,所以氢离子是不足的,因此溶解的铜是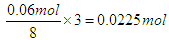 ,所以其浓度是0.225mol/L。答案选A。
,所以其浓度是0.225mol/L。答案选A。
本题难度:简单