时间:2017-01-12 18:47:17
1、填空题 抗氧剂亚硫酸钠可利用硫酸工业的炉气和尾气与纯碱反应来制取,生产流程如下图: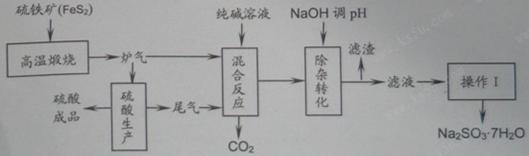
已知:①炉气、尾气中含有SO2;②混合反应中还溶解有少量Fe2O3、MgO等矿尘。
(1)煅烧1molFeS2放出热量为853kJ,则FeS2燃烧的热化学方程式为_____________。
(2)“混合反应”中纯碱(Na2CO3)参与反应的化学方程式为_____________(任写一个)。
(3)用NaOH“除杂”时,主要的离子方程式为_____________(任写一个)。
(4)通过“操作Ⅰ”可以得到亚硫酸钠晶体,写出主要操作步骤的名称:__________。
(3)硫酸生产中炉气转化反应为:2SO2(g)+ O2(g) 2SO3(g)。研究发现,SO3的体积分数(SO3%)随温度(T)的变化如曲线Ⅰ所示。下列判断正确的是________
2SO3(g)。研究发现,SO3的体积分数(SO3%)随温度(T)的变化如曲线Ⅰ所示。下列判断正确的是________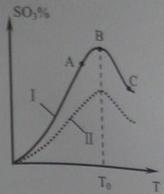
A.该反应的正反应为放热反应
B.曲线Ⅰ上A、C两点反应速率的关系是: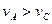
C.反应达到B点时,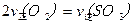
D.已知V2O5的催化效果比Fe2O3好,若Ⅰ表示用V2O5催化剂的曲线,则Ⅱ是Fe2O3作催化剂的曲线
参考答案:(1)4FeS2(S)+11O2(g)=8SO2(g)+2F
本题解析:略
本题难度:简单
2、填空题 氨是一种重要的化工原料,氨的合成与应用是当今重要研究内容之一。不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2起始物质的量之比为1∶3)。
 压强(Mpa) 压强(Mpa) 氨的平 氨的平衡含量(%) 温度(℃) | 0.1 | 10 | 20 | 30 | 60 | 100 | ||||||||||||
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 9 5.4 5.4 | 98.8 | ||||||||||||
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 | ||||||||||||
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 | ||||||||||||
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 | ||||||||||||
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 回答下列有关问题: (1)利用表中数据推断得出合成氨的反应是__________反应(填“放热”、“吸热”或“无热量变化”)。 (2)根据表中数据,在200℃和100MPa时,平衡体系中NH3的物质的量分数最高,而实际工业生产不选用该条件的主要原因是___________________________________。 (3)一定条件下,对在密闭容器中进行的合成氨反应达平衡后,其他条件不变时,若同时压缩容器的体积和升高温度达新平衡后,与原平衡相比,请将有关物理量的变化的情况填入下表中(填“增大”、“减小”或“可能增大也可能减小”):
|