时间:2017-01-12 17:47:52
1、填空题 2010年上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED)。目前市售LED品片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、lnGaN(氮化铟镓)为主。已知镓是铝同族下一周期的元素。砷化镓的晶胞结构如图。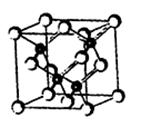
试回答:
⑴镓的基态原子的电子排布式是?????????????????。
⑵砷化镓晶胞中所包含的砷原子(白色球)个数为???????????,与同一个镓原子相连的砷原子构成的空间构型为??????????????。
⑶N、P、As处于同一主族,其氢化物沸点由高到低的顺序是????????。 (用氢化物分子式表示)
⑷砷化镓可由(CH3)3Ga和AsH3在700℃时制得。(CH3)3Ga中镓原子的杂化方式为???????????。
⑸比较二者的第一电离能:As______Ga(填“<”、“>”或“=”)。
⑹下列说法正确的是?????????????(填字母)。
A.砷化镓晶胞结构与NaCl相同? B.GaP与GaAs互为等电子体
C.电负性:As>Ga????????????D.砷化镓晶体中含有配位键
参考答案:⑴l s22s22p63s23p63d104s24p1(或[
本题解析:
试题分析:⑴31号元素镓的基态原子的电子排布式是l s22s22p63s23p63d104s24p1(或[Ar]3d104s24p1)⑵砷化镓晶胞中所包含的砷原子(白色球)个数为8×1/8+6×1/2="4;" 与同一个镓原子相连的砷原子构成的空间构型为正四面体型⑶N、P、As处于同一主族,其氢化物都是分子晶体。结构相似,对于结构相似的物质来说,相对分子质量越大。分子间的作用力就越大,克服分子间作用力使物质融化或汽化需要的能量就越高。即熔沸点越高。但由于氨气的分子之间还存在氢键,增加了分子之间的相
本题难度:一般
2、填空题 (1)由A、B两元素组成的离子晶体结构(甲)如图所示,则该晶体的化学式是:___________。 
(2)C原子的最外层电子排布为nsnnpm,其某一激发态可使这两个亚层的每一个轨道都处于全满状态,1个C原子与2个D原子结合,使双方都达到8电子稳定结构。则在C与D形成的分子中,C原子发生轨道的杂化方式是________,分子构型是________,从成键方式看,该分子中含有的共价键的类型和数目分别是________________
(3)C与D形成的常见晶体(乙),与甲晶体的熔点相比,乙____甲,其原因是___________________。
参考答案:(1)AB或BA
(2)sp;直线形;2个σ键、2个
本题解析:
本题难度:一般
3、选择题 下列说法中正确的是[???? ]
A.原子和其他原子形成共价键时,其共价键数一定等于原子的价电子数
B.离子化合物中只有离子键,共价化合物中只有共价键
C.铵根离子呈正四面体结构
D.氨分子中氢原子、氮原子的化合价已饱和,不能再与其他原子或离子成键
参考答案:C
本题解析:
本题难度:简单
4、选择题 既有离子键,又有极性键的化合物是( )
A.Na2O2
B.H2S
C.H2O2
D.NaOH
参考答案:D
本题解析:
本题难度:一般
5、填空题 以下列出了四种物质的分子结构示意图,其中圆圈表示原子核以及包含除价电子以外电子的示意图。黑点表示未形成共价键的最外层电子,直线表示共价键,且图中各分子仅由一、二周期元素的原子构成。在括号内填写四种物质化学式。
(1)∶O≡O∶(???)
(4)O—O≡O∶(??? )
参考答案:(1)N2?(2)HF?(3)H2O2?(4)HCN
本题解析:图中各分子仅由一、二周期元素的原子构成,分析判断的切入点是最外层电子数目。如(1)中每个原子提供3个电子共用,尚余2个电子,说明该原子最外层有5个电子,故为N。同理可判断(2)为HF,(3)为H2O2,(4)为HCN。
本题难度:简单