时间:2017-01-06 13:36:23
实验题 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
NH2COONH4(s)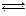 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度 下的平衡数据列于下表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 | ||||||||||||||||||
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 | ||||||||||||||||||
| 平衡气体总浓度/mol?L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 ①可以判断该分解反应已经达到平衡的是???????。 A.2v(NH2)=v(CO2) B.密闭容器中总压强不变 C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变 ②根据表中数据,列式计算25.0℃时的分解平衡常数: ③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量是?????????(填“增加”,“减少”或“不变”)。 ④氨基甲酸铵分解反应的焓变△H???????O(填“>”、“=”或“<”),熵变△S????????O (填“>”、“=”或“<”)。 (2)已知:NH2COONH4+2H2O  NH4HCO2+NH3?H2O NH4HCO2+NH3?H2O该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO2)时间的变化趋势如图所示。  ⑤计算 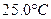 时,0-6min 氨基甲酸铵水解反应的平抑速率 ______。 时,0-6min 氨基甲酸铵水解反应的平抑速率 ______。⑥根据图中信息,如何说明该水解反应速率随温度升高而增大:_____。 实验题 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
|