时间:2017-01-06 12:35:31
实验题 (12分)某兴趣小组在研究性学习中设计了如下实验来探究Fe与H2SO4反应的过程,装置如下图所示。实验步骤:①在烧瓶中加入80% H2SO4;②将提拉式铁丝插入溶液中,观察到先有少量气泡,后停止的现象;③加热烧瓶至有较多量气体产生时停止加热,品红试液颜色褪去烧瓶中溶液变为棕黄色。④一段时间后KMnO4/H+颜色不再变浅,但NaOH溶液中仍有气泡逸出,在导管口处可以点燃该气体。烧瓶中液体变为浅绿色。根据以上实验回答: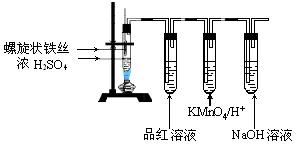
(1)在步骤②中现象说明?????????????????????????????????????????????????;
(2)在步骤③中,品红褪色的原因是????????????????????????????????????????;
(3)写出步骤④中,使溶液变为浅绿色的可能原因(用离子方 程式表示)????????????????????????;???????????????????????????????????????????;
(4)设计实验证明反应后的溶液中有Fe2+:???????????????????????????????????。
实验题 (12分)某兴趣小组在研究性学习中设计了如下实验来探究Fe与H2SO4反应的过程,装置如下图所示。实验步骤:①在烧瓶中加入80% H2SO4;②将提拉式铁丝插入溶液中,观察到先有少量气泡,后停止的现象;③加热烧瓶至有较多量气体产生时停止加热,品红试液颜色褪去烧瓶中溶液变为棕黄色。④一段时间后KMnO4/H+颜色不再变浅,但NaOH溶液中仍有气泡逸出,在导管口处可以点燃该气体。烧瓶中液体变为浅绿色。根据以上实验回答:
(1)在步骤②中现象说明?????????????????????????????????????????????????;
(2)在步骤③中,品红褪色的原因是????????????????????????????????????????;
(3)写出步骤④中,使溶液变为浅绿色的可能原因(用离子方程式表示)????????????????????????;????????????????? ??????????????????????????;
(4)设计实验证明反应后的溶液中有Fe2+:???????????????????????????????????。
本题答案:(1)常温下Fe在80%的H2SO4溶液中可以发生钝化;(2
本题解析:【分析预测及备考建议】考试大纲中明确规定学生必须有“观察记录实验现象,分析实验结果和处理实验数据,得出正确结论的能力”,“能将实验问题(题设情境)分解,找出解答的关键。运用自己储存的知识,将它们分解、迁移、重组,使问题得到解决的应用能力。”
【答题技巧】(1)常温下将Fe丝插入硫酸中会有气泡产生,说明发生了反应,但一会儿后即停止,说明Fe在硫酸中发生了钝化,阻止了反应的进一步进行。(2)Fe与浓H2SO4反应可能是浓H2SO4强氧化性或是发生置换反应生成H2,则实验现象品红溶液褪色说明产生的是SO2气体。(3)溶液变为浅绿色说明产生了Fe2+,一种可能是Fe与H2SO4反应生成FeSO4,也存在Fe3+离子转化为Fe2+。(4)在溶液中加入KSCN溶液时,不变红则说明无Fe3+,再加入氯水后溶液变红,说明原溶液中存在Fe2+,被氯水氧化成Fe3+后使KSCN变为红色。
本题所属考点:【探究性实验的设计与评价】
本题难易程度:【一般】