时间:2017-01-04 17:15:58
填空题 (1)二氧化硫的催化氧化的过程如图所示,其中a、c二步的化学方程式可表示为: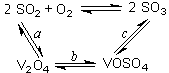
SO2+V2O5 SO3+ V2O4
SO3+ V2O4
4VOSO4+O2 2V2O5+4SO3。
2V2O5+4SO3。
该反应的催化剂是????????(写化学式)
(2) 550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应达平衡后,体系总压强为0.10 M Pa。试计算反应2SO3 2SO2+O2在550 ℃时的平衡常数K=?????。
2SO2+O2在550 ℃时的平衡常数K=?????。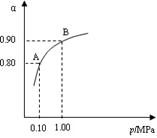
(3)550 ℃时,将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应 达平衡后,下列措施中能使n(SO3)/n(SO2)增大的是???????
A.升高温度??????????????????
B.充入He(g),使体系总压强增大
C.再充入2 mol SO2和1 mol O2?
D.再充入1 mol SO2和1 mol O2
(4)维持温度不变条件下使之发生如下反应:2SO2+O2 2SO3,有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个 容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等(如下图所示)。
2SO3,有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个 容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等(如下图所示)。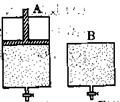
试填写下列空格:
A容器达到平衡时所需的时间比B容器__________(填:“短或长”);平衡时A容器中SO2的转化率比B容器_______(填:“大或小”);达到所述平衡后,若向两容器中通入等物质的量的原反应气体,达到平衡时,A容器的混合气体中SO3的体积分数_________(填“增大”、“减小”或“不变”,下同);B容器的混合气体中SO3的体积分数_________。
填空题 (1)二氧化硫的催化氧化的过程如图所示,其中a、c二步的化学方程式可表示为:
SO2+V2O5 SO3+ V2O4
SO3+ V2O4
4VOSO4+O2 2V2O5+4SO3。
2V2O5+4SO3。
该反应的催化剂是????????(写化学式)
(2) 550 ℃时,SO2转化为SO3的平衡 转化率(α)与体系总压强(p)的关系如图所示。将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应达平衡后,体系总压强为0.10 M Pa。试计算反应2SO3 2SO2+O2在550 ℃时的平衡常数K=?????。
2SO2+O2在550 ℃时的平衡常数K=?????。
(3)550 ℃时,将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应 达平衡后,下列措施中能使n(SO3)/n(SO2)增大的是???????
A.升高温度??????????????????
B.充入He(g),使体系总压强增大
C.再充入2 mol SO2和1 mol O2?
D.再充入1 mol SO2和1 mol O2
(4)维持温度不变条件下使之发生如下反应:2SO2+O2 2SO3,有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等(如下图所示)。
2SO3,有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等(如下图所示)。
试填写下列空格:
A容器达到平衡时所需的时间比B容器__________(填:“短或长”);平衡时A容器中SO2的转化率比B容器_______(填:“大或小”);达到所述平衡后,若向两容器中通入等物质的量的原反应气体,达到平衡时,A容器的混合气体中SO3的体积分数_________(填“增大”、“减小”或“不变”,下同);B容器的混合气体中SO3的体积分数_________。
本题答案:(1)V2O5;(2)400 L?mol-1;(3)CD;(
本题解析:
试题分析:(1)根据题给信息结合催化剂参与化学反应的机理分析,催化剂为V2O5;(2)根据化学平衡计算的三段式进行计算,由题给图像知,体系总压强为0.10M Pa,此时二氧化硫的转化率为80%,??????????????2SO2+O2 2SO3
2SO3
起始量(mol)? 2?????1?????????0
变化量 (mol)2×0.8? 0.8??? 2×0.8
平衡量 (mol) 0.4?? 0.2??????? 1.6
平衡时各物质的浓度为:[SO2]=0.08mol/L,[O2]=0.04mol/L,[SO3]="0.32mol/L" 代入平衡常数的表达式计算得到平衡常数K="400" L?mol-1;(3)550 ℃时,将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应达平衡后,要使n(SO3)/n(SO2)增大,平衡需向正向移动,A、该反应正向为放热反应,升高温度,平衡逆向移动,错误;B、充入He(g),使体系总压强增大,与反应相关的物质浓度不变,平衡不移动,错误;C、再充入2 mol SO2和1 mol O2,相当于加压,平衡正向移动,正确;D、再充入1 mol SO2和1 mol O2,平衡正向移动,正确;选CD;(4)因A容器保持恒压,反应过程中体积变小,浓度增大,根据浓度越大,化学反应速率越快,到达平衡的时间越短,所以达到平衡所需时间A比B短,A容器体积减少,压强增大,平衡向正反应方向移动,所以A中SO2的转化率比B大;向两容器中通入等量的原反应气体,达到平衡后,A中建立的平衡与原平衡等效,所以SO3的体积分数不变,B容器中建立的平衡相当于在原平衡的基础上增大压强,平衡正向移动,B容器中SO3的体积分数增大。
本题所属考点:【反应速率与平衡的有关计算】
本题难易程度:【困难】