时间:2016-12-30 13:25:09
计算题 (8分)某研究小组取一定质量的镁铝合金放入200mL稀硫酸中,固体完全溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积的变化关系如图所示。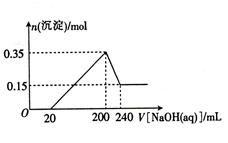
求:(1)该合金的质量
(2)原稀硫酸的物质的量浓度
计算题 (8分)某研究小组取一定质量的镁铝合金放入200mL稀硫酸中,固体完全溶解 后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积的变化关系如图所示。
求:(1)该合金的质量
(2)原稀硫酸的物质的量浓度
本题答案:∵加入过量NaOH溶液,最终生成的沉淀只有Mg(OH)2,<
本题解析:
试题分析:根据图像分析,镁铝溶于硫酸后溶液中有硫酸镁和硫酸铝和硫酸,所以先加入氢氧化钠没有沉淀生成,当氢氧化钠的体积为20毫升时开始出现氢氧化镁和氢氧化铝沉淀,沉淀最大值为0.35摩尔,然后氢氧化铝沉淀溶于氢氧化钠,最后剩余0.15摩尔氢氧化镁沉淀,所以氢氧化铝沉淀的物质的量为0.35-0.15=0.20摩尔,从而计算合金的质量。根据200到240只有氢氧化铝和氢氧化钠反应,所以可以计算氢氧化钠的物质的量或浓度,当氢氧化钠的体积为200毫升时,溶液中只有硫酸钠,所以根据硫酸钠的化学式找硫酸和氢氧化钠的关系即可计算硫酸的浓度。
考点:金属的性质,氢氧化铝的两性。
本题所属考点:【物质的量】
本题难易程度:【一般】