填空题 (18分)实验是化学学习的基础,请完成以下实验填空:
Ⅰ.(1)常压下,已知甲烷的热值是55.625KJ/g,请写出甲烷燃烧热的热化学方程式 。
(2)某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。若实验中大约要使用245 mL NaOH溶液,配制0.50 mol/L NaOH溶液时至少需要称量NaOH固体 g。
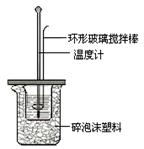
(3)测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示。装置中环形玻璃搅拌棒的搅拌方法是 ,该实验过程中量筒最少要准备 个。
(4)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①下表中的a= ℃
温度
实验
次数
| 起始温度t1/℃
| 终止温度
t2/℃
| 温度差平均值
(t2-t1)/℃
|
H2SO4
| NaOH
| 平均值
|
1
| 26.2
| 26.0
| 26.1
| 30.1
| a
|
2
| 27.0
| 27.4
| 27.2
| 31.3
|
3
| 25.9
| 25.9
| 25.9
| 29.8
|
4
| 26.4
| 26.2
| 26.3
| 31.4
|
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c="4.18" J/(g·℃)。则中和热△H=
(取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)
。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
e、配置氢氧化钠溶液的氢氧化钠固体中混有氧化钠
Ⅱ.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)硫酸铜溶液可以加快氢气生成速率的原因是_______________________________;
(2)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
 实验 实验
混合溶液
| A
| B
| C
| D
| E
| F
|
4 mol·L-1 H2SO4/mL
| 30
| V1
| V2
| V3
| V4
| V5
|
饱和CuSO4溶液/mL
| 0
| 0.5
| 2.5
| 5
| V6
| 20
|
H2O/mL
| V7
| V8
| V9
| V10
| 10
| 0
|
请完成此实验设计,其中:V1=__________, V9=________;
(3)该同学最后得出的结论为当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因
。
填空题 (18分)实验是化学学习的基础,请完成以下实验填空:
Ⅰ.(1)常压下,已知甲烷的热值是55.625KJ/g,请写出甲烷燃烧热的热化学方程式 。
(2)某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。若实验中大约要使用245 mL NaOH溶液,配制0.50 mol/L NaOH溶液时至少需要称量NaOH固体 g。
(3)测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示。装置中环形玻璃搅拌棒的搅拌方法是 ,该实验过程中量筒最少要准备 个。

(4)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①下表中的a= ℃
温度
实验
次数
| 起始温度t1/℃
| 终止温度
t2/℃
| 温度差平均值
(t2-t1)/℃
|
H2SO4
| NaOH
| 平均值
|
1
| 26.2
| 26.0
| 26.1
| 30.1
| a
|
2
| 27.0
| 27.4
| 27.2
| 31.3
|
3
| 25.9
| 25.9
| 25.9
| 29.8
|
4
| 26.4
| 26.2
| 26.3
| 31.4
|
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c="4.18" J/(g·℃)。则中和热△H=
(取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)
。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
e、配置氢氧化钠溶液的氢氧化钠固体中混有氧化钠
Ⅱ.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)硫酸铜溶液可以加快氢气生成速率的原因是_______________________________;
(2)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
 实验 实验
混合溶液
| A
| B
| C
| D
| E
| F
|
4 mol·L-1 H2SO4/mL
| 30
| V1
| V2
| V3
| V4
| V5
|
饱和CuSO4溶液/mL
| 0
| 0.5
| 2.5
| 5
| V6
| 20
|
H2O/mL
| V7
| V8
| V9
| V10
| 10
| 0
|
请完成此实验设计,其中:V1=__________, V9=________;
(3)该同学最后得出的结论为当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因
� 60; 。
本题答案:Ⅰ、(1)CH4(g)+2O2(g)=CO2(g)+2H2O
本题解析:
试题解析:Ⅰ.(1)常压下,已知甲烷的热值是55.625KJ/g,则1mol甲烷完全燃烧放出的热量为=55.625KJ/g×16g/mol=890KJ/mol,甲烷燃烧热的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H =-890kJ/mol;(2)实验中大约要使用245 mL NaOH溶液,配制0.50 mol/L NaOH溶液时,容量瓶的规格为250ml,需要称量NaOH固体=0.5mol/L×0.25L×40g/mol=5.0g;(3)测定稀硫酸和稀氢氧化钠中和热的实验中环形玻璃搅拌棒的搅拌方法是环绕温度计上下移动,该实验过程中量筒最少要准备2个,一个量算,另一个量碱;(4)①根据表中数据可知,温度的差值是(℃)4.0、4.1、3.9、5.1,所以根据表中数据实验4的误差太大,舍去。因此温度差的平均值是(4.0+3.9+4.1)℃÷3=4.0℃;②反应中生成0.025mol水,所以反应热△H=-0.00418×4.0×80÷0.025=-53.5 kJ/mol;③53.5 kJ/mol小于57.3 kJ/mol,选项a有热量损失,测定结果偏小;配制0.50 mol/L NaOH溶液时俯视刻度线读数时,浓度偏大,测定结果偏高;次数越多,热量损失越多;用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,则温度差值减小,测定结果偏小;用量筒量取NaOH溶液的体积时仰视读数,则氢氧化钠的体积增加,测定结果偏高,实验答案选acd;Ⅱ.(1)Zn和硫酸的反应中加入少量的CuSO4溶液,能置换出一定量Cu,在溶液中形成Cu/Zn原电池,而加快化学反应速率;(2)要对比试验效果,那么除了反应的物质的量不一样以外,要保证其它条件相同,而且是探究硫酸铜量的影响,那么每组硫酸的量要保持相同,六组反应的总体积也应该相同.A组中硫酸为30ml,那么其它组硫酸量也都为30ml.而硫酸铜溶液和水的总量应相同,B组中硫酸30ml,水为0,那么总量为20ml,所以V9=17.5ml,V1=30ml.
考点:燃烧热、中和热、化学反应速率
本题所属考点:【化学反应与能量】
本题难易程度:【一般】
Eternal vigilance is the price of liberty. 自由的代价是永远警惕。

 实验
实验
 实验
实验