时间:2016-12-27 01:31:40
填空题 (16分)实现反应CH4(g)+CO2(g) 2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。
2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。
(1)已知:① 2CO(g)+O2(g)=2CO2(g) △H1=-566 kJ·mol-1
② 2H2(g)+O2(g)=2H2O(g) △H2=-484 kJ·mol-1
③ CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3=-802 kJ·mol-1
则△H0= kJ·mol-1
(2)在密闭容器中,通入2.5mol的CH4与2.5mol CO2,一定条件下发生反应:CH4(g)+CO2(g) 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图。
2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图。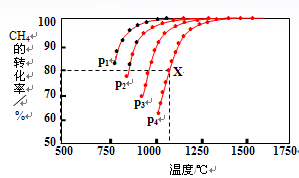
据图可知,p1、p2、 p3、p4由大到小的顺序 。
(3)C O和H2还可以通过反应C(s)+H2O(g) CO(g)+H2 (g) 制取。
CO(g)+H2 (g) 制取。
① 在恒温恒容下,若从反应物出发建立平衡,已达到平衡的是
填空题 (16分)实现反应CH4(g)+CO2(g) 2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。
2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。
(1)已知:① 2CO(g)+O2(g)=2CO2(g) △H1=-566 kJ·mol-1
② 2H2(g)+O2(g)=2H2O(g) △H2=-484 kJ·mol-1
③ CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3=-802 kJ·mol-1
则△H0= kJ· mol-1
(2)在密闭容器中,通入2.5mol的CH4与2.5mol CO2,一定条件下发生反应:CH4(g)+CO2(g) 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图。
2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图。
据图可知,p1、p2、 p3、p4由大到小的顺序 。
(3)CO和H2还可以通过反应C(s)+H2O(g) CO(g)+H2 (g) 制取。
CO(g)+H2 (g) 制取。
① 在恒温恒容下,若从反应物出发建立平衡,已达到平衡的是

 2CO(g)+2H2(g) △H0:
2CO(g)+2H2(g) △H0: 2CO(g)+2H2(g)为气体分子数增加的反应,所以在温度不变的条件下,减压化学平衡正向移动,CH4的转化率增大,所以p4>p3>p2>p1。(3) 通过反应C(s)+H2O(g)
2CO(g)+2H2(g)为气体分子数增加的反应,所以在温度不变的条件下,减压化学平衡正向移动,CH4的转化率增大,所以p4>p3>p2>p1。(3) 通过反应C(s)+H2O(g) CO(g)+H2(g)制取CO和H2:①A、因为反应在恒温恒容条件下反应,而反应为气体分子数增加的反应,若化学反应不平衡,压强会增大,若体系压强不变,则可说明达到了平衡状态;故A正确。B、反应开始加入C(s)和H2O(g)可知反应完全正向建立平衡,由化学方程式可知生成的CO和H2的物质的量是相等的,也就是说任意时刻H2与CO的物质的量之比总为1:1,所以当H2与CO的物质的量之比为1:1时不能确定是否达到平衡状态;故B错误。C、由方程式可知该反应为固体生成气体的反应,随着反应的进行,气体的质量增加,但体积不变,所以密度增大,当气体密度不变时,则说明反应达到了平衡状态;故C正确。D、消耗1mol H2O(g)表示的为正反应速率,生成1mol H2表示的仍为正反应速率,无法确定正反应速率与逆反应速率是否相等,所以无法确定是否达到平衡。故D错误。综上所述可以说明反应达到平衡的为AC。②、恒温下,在2L的密闭容器中同时投入四种物质,10min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、2molH2(g)和2molC(s),可得各气体物质的平衡浓度分别为:c(H2O)=1/2mol/L、c(CO)=1/2mol/L、c(H2)=1mol/L,则该反应的平衡常数:K=c(CO)×c(H2)/c(H2O)=1mol/L若此时加压,平衡向着气体分子数减小的方向即逆反应方向移动;③、在第10分钟时氢气的物质的量为2mol,随着化学反应的逆向移动,氢气的物质的量逐渐减小。但由于可逆反应不能进行到底,再次达平衡时氢气的物质的量应大于1mol。故图像为
CO(g)+H2(g)制取CO和H2:①A、因为反应在恒温恒容条件下反应,而反应为气体分子数增加的反应,若化学反应不平衡,压强会增大,若体系压强不变,则可说明达到了平衡状态;故A正确。B、反应开始加入C(s)和H2O(g)可知反应完全正向建立平衡,由化学方程式可知生成的CO和H2的物质的量是相等的,也就是说任意时刻H2与CO的物质的量之比总为1:1,所以当H2与CO的物质的量之比为1:1时不能确定是否达到平衡状态;故B错误。C、由方程式可知该反应为固体生成气体的反应,随着反应的进行,气体的质量增加,但体积不变,所以密度增大,当气体密度不变时,则说明反应达到了平衡状态;故C正确。D、消耗1mol H2O(g)表示的为正反应速率,生成1mol H2表示的仍为正反应速率,无法确定正反应速率与逆反应速率是否相等,所以无法确定是否达到平衡。故D错误。综上所述可以说明反应达到平衡的为AC。②、恒温下,在2L的密闭容器中同时投入四种物质,10min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、2molH2(g)和2molC(s),可得各气体物质的平衡浓度分别为:c(H2O)=1/2mol/L、c(CO)=1/2mol/L、c(H2)=1mol/L,则该反应的平衡常数:K=c(CO)×c(H2)/c(H2O)=1mol/L若此时加压,平衡向着气体分子数减小的方向即逆反应方向移动;③、在第10分钟时氢气的物质的量为2mol,随着化学反应的逆向移动,氢气的物质的量逐渐减小。但由于可逆反应不能进行到底,再次达平衡时氢气的物质的量应大于1mol。故图像为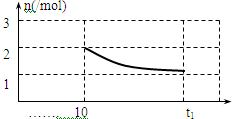
本题所属考点:【燃烧热】
本题难易程度:【困难】