时间:2016-12-26 16:50:09
选择题 (8分)2013年以来全国各地都遭遇“十面霾伏”。其中,二氧化硫、氮氧化物和可吸入颗粒物是雾霾的主要组成成分。综合治理其污染是环境化学当前的重要研究内容。
(1)NO2有较强的氧化性,能将SO2氧化生成SO3,本身被还原为NO,已知下列两反应过程中能量变化如图所示: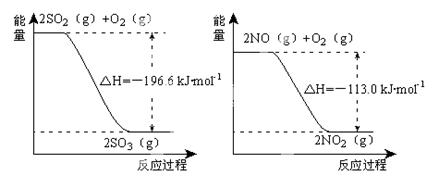
则NO2氧化SO2的热化学方程式为 _____________________________ 。
(2)SO2与O2反应时的平衡转化率与温度、压强的关系如图所示。根据图示回答下列问题: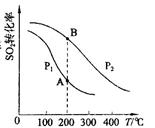
①压强:Pl P2(填“>”、“=”或“<”)。
②平衡常数:A点 B点(填“>”、“=”或“<”)。
③200℃下,将一定量的SO2和O2充人体积为1 L的密闭容器中,经10min后测得容器中各物质的物质的量如下表所示:
| 气体 | SO2 | O2 | SO3 |
| 物质的量(mol) | 1.6 | 1.8 | 0.4 |
选择题 (8分)2013年以来全国各地都遭遇“十面霾伏”。其中,二氧化硫、氮氧化物和可吸入颗粒物是雾霾的主要组成成分。综合治理其污染是环境化学当前的重要研究内容。
(1)NO2有较强的氧化性,能将SO2氧化生成SO3,本身被还原为NO,已知下列两反应过程中能量变化如图所示:
则NO2氧化SO2的热化学方程式为 _____________________________ 。
(2)SO2与O2反应时的平衡转化率与温度、压强的关系如图所示。根据图示回答下列问题:
①压强:Pl P2(填“>”、“=”或“<”)。
②平衡常数:A点 B点(填“>”、“=”或“<”)。
③200℃下,将一定量的SO2和O2充人体积为1 L的密闭容器中,经10min后测得容器中各物质的物质的量如下表所示:
| 气体 | SO2 | O2 | SO3 |
| 物质的量(mol) | 1.6 | 1.8 | 0.4 |
 SO3(g)+NO(g) ΔH=-41.8kJ?mol?1;(2)①SO2与O2反应的反应为气体物质的量减小的反应,增大压强,平衡正向移动,二氧化硫的转化率增大;由图像可知,压强为P2时二氧化硫平衡转化率较大,即压强:Pl <P2;②由图像可知,A、B两点温度相同,平衡常数的影响因素为温度,故平衡常数:A点=B点;③根据公式v=△n/V△t 代入题给数据计算v (SO3)=0.4mol/1L×10min=0.04mol/(L·min),根据速率之比等于化学计量数之比得10min内该反应的反应速率v(O2)= 0.02mol/(L·min);根据“变量不变,已达平衡”判断;a.分析题给数据知,随着反应的进行SO2和O2的体积比不断变化,当其保持不变时已达平衡,正确;b.随着反应的进行容器内气体的物质的量不断减小,体系的压强不断减小,当其保持不变时已达平衡,正确;c.等容条件下混合气体的密度为恒量,不能作平衡标志,错误;d.SO2和SO3物质的量之和始终为2mol,不能作平衡标志,错误,选ab。(3)①氨气与NO反应生成氮气和水,利用化合价升降法配平,化学方程式为4NH3+6NO=5N2+6H2O;②根据上述反应知,该反应转移的电子数为12e-,还原产物比氧化产物多1mol,若还原产物比氧化产物多0.5mol,则反应转移电子数为6mol或6×6.02×1023。
SO3(g)+NO(g) ΔH=-41.8kJ?mol?1;(2)①SO2与O2反应的反应为气体物质的量减小的反应,增大压强,平衡正向移动,二氧化硫的转化率增大;由图像可知,压强为P2时二氧化硫平衡转化率较大,即压强:Pl <P2;②由图像可知,A、B两点温度相同,平衡常数的影响因素为温度,故平衡常数:A点=B点;③根据公式v=△n/V△t 代入题给数据计算v (SO3)=0.4mol/1L×10min=0.04mol/(L·min),根据速率之比等于化学计量数之比得10min内该反应的反应速率v(O2)= 0.02mol/(L·min);根据“变量不变,已达平衡”判断;a.分析题给数据知,随着反应的进行SO2和O2的体积比不断变化,当其保持不变时已达平衡,正确;b.随着反应的进行容器内气体的物质的量不断减小,体系的压强不断减小,当其保持不变时已达平衡,正确;c.等容条件下混合气体的密度为恒量,不能作平衡标志,错误;d.SO2和SO3物质的量之和始终为2mol,不能作平衡标志,错误,选ab。(3)①氨气与NO反应生成氮气和水,利用化合价升降法配平,化学方程式为4NH3+6NO=5N2+6H2O;②根据上述反应知,该反应转移的电子数为12e-,还原产物比氧化产物多1mol,若还原产物比氧化产物多0.5mol,则反应转移电子数为6mol或6×6.02×1023。本题所属考点:【化学平衡】
本题难易程度:【一般】