时间:2016-12-25 23:38:54
选择题 下列说法不正确的是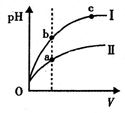
A.等物质的量浓度的NH4HSO4溶液和NaOH溶液等体积混合,溶液中各离子浓度大小关系为来源:91考试网 www.91eXam.org:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-)
B.25℃时,将a mo1·L-l氨水与0.01 moI·L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(C1-),用含a 的代数式表示NH3·H2O的电离常数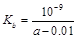
C.某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线如上图所示。II为醋酸稀释时pH的变化曲线,且a、b两点水的电离程度:a<b
D.已知298K时氢氰酸(HCN)的Ka=4.9×10-10、碳酸的Ka1=4.4×10-7,Ka2=4.7×10-11,据此可推测将氢氰酸加入到碳酸钠溶液中能观察到有气泡产生
选择题 下列说法不正确的是
A.等物质的量浓度的NH4HSO4溶液和NaOH溶液等体积混合,溶液中各离子浓度大小关系为:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-)
B.25℃时,将a mo1·L-l氨水与0.01 moI·L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(C1-),用含a 的代数式表示NH3·H2O的电离常数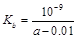
C.某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线如上图所示。II为醋酸稀释时pH的变化曲线,且a、b两点水的电离程度:a<b
D.已知298K时氢氰酸(HCN)的Ka=4.9×10-10、碳酸的Ka1=4.4×10-7,Ka2=4.7×10-11,据此可推测将氢氰酸加入到碳酸钠溶液中能观察到有气泡产生
本题答案:D
本题解析:
试题分析:A项等物质的量浓度的 NH4HSO4溶液和NaOH溶液等体积混合,反应后溶液溶质为(NH4)2SO4、Na2SO4等物质的量混合液,NH4+水解溶液呈酸性,故溶液中离子浓度大小关系为:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-),A项正确;B项25℃时,将a mo1·L-l氨水与0.01 moI·L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(C1-),则溶液中c(H+)=c(OH-)=10-7mol/L,故NH3·H2O的电离常数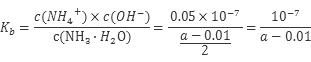 ,B项正确;C项为某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线,由曲线可知曲线Ⅰ 稀释PH变化大,故曲线Ⅰ 为盐酸稀释曲线,曲线Ⅱ为醋酸稀释曲线,a点PH值小,对水的抑制程度大,故a、b 两点水的电离程度:a<b,故C项正确;D项已知298K时氢氰酸(HCN)的Ka=4.9×10-10、碳酸的Ka1=4.4×10-7,Ka2=4.7×10-11,由电离常数可知酸性:H2CO3>HCN>HCO3—,故据此可推测将氢氰酸加入到碳酸钠溶液中只能生成HCO3—,不能生成二氧化碳,故不会观察到有气泡产生,D项错误,本题选D。
,B项正确;C项为某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线,由曲线可知曲线Ⅰ 稀释PH变化大,故曲线Ⅰ 为盐酸稀释曲线,曲线Ⅱ为醋酸稀释曲线,a点PH值小,对水的抑制程度大,故a、b 两点水的电离程度:a<b,故C项正确;D项已知298K时氢氰酸(HCN)的Ka=4.9×10-10、碳酸的Ka1=4.4×10-7,Ka2=4.7×10-11,由电离常数可知酸性:H2CO3>HCN>HCO3—,故据此可推测将氢氰酸加入到碳酸钠溶液中只能生成HCO3—,不能生成二氧化碳,故不会观察到有气泡产生,D项错误,本题选D。
考点:溶液中平衡离子关系。
本题所属考点:【弱电解质电离平衡】
本题难易程度:【困难】