时间:2016-12-25 23:30:43
选择题 下列有关计算的分析正确的是
A.某溶液100mL,其中含硫酸0.03mol,硝酸0.04mol,若在该溶液中投入1.92 g铜粉微热,反应后放出一氧化氮气体约为0.015mol
B.室温时,在容积为a mL的试管中充满NO2气体,然后倒置在水中到管内水面不再上升时为止;再通入b mL O2,则管内液面又继续上升,测得试管内最后剩余气体为c mL,且该气体不能支持燃烧.则a、b的关系是a=4b+c
C.已知某温度Ksp(Ag2S)=6×10-50,Ksp(AgCl)=2×10-6,则2AgCl(s)+S2-(aq) Ag2S(s)+2Cl-(aq)的平衡常数约为6.7×10-37
Ag2S(s)+2Cl-(aq)的平衡常数约为6.7×10-37
D.在25 ℃下,将2a mol·L-1的氨水与0.02 mol·L-1的盐酸等体积混合 ,反应完全时溶液中c(NH4+)=c(Cl-),则用含a的代数式表示NH3·H2O的电离常数 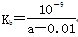
选择题 下列有关计算的分析正确的是
A.某溶液100mL,其中含硫酸0.03mol,硝酸0.04mol,若在该溶液中投入1.92 g铜粉微热,反应后放出一氧化氮气体约为0.015mol
B.室温时,在容积为a mL的试管中充满NO2气体,然后倒置在水中到管内水面不再上升时为止;再通入b mL O2,则管内液面又继续上升,测得试管内最后剩余气体为c mL,且该气体不能支持燃烧.则a、b的关系是a=4b+c
C.已知某温度Ksp(Ag2S)=6×10-50,Ksp(AgCl)=2×10-6,则2AgCl(s)+S2-(aq) Ag2S(s)+2Cl-(aq)的平衡常数约为6.7×10-37
Ag2S(s)+2Cl-(aq)的平衡常数约为6.7×10-37
D.在25 ℃下,将2a mol·L-1的氨水与0.02 mol·L-1的盐酸等体积混合,反应完全时溶液中c(NH4+)=c(Cl-),则用含a的代数式表示NH3·H2O的电离常数 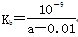
本题答案:D
本题解析:
试题分析:A.某溶液100mL,其中含硫酸0.03mol,硝酸0.04mol,则氢离子物质的量是0.1mol。若在该溶液中投入1.92 g铜粉即0.03mol铜微热,根据方程式8H++3Cu+2NO3-=3Cu2++4H2O+2NO↑可知反应中硝酸根和氢离子过量,则反应后放出一氧化氮气体约为0.02mol,A错误;B.室温时,在容积为a mL的试管中充满NO2气体,然后倒置在水中到管内水面 不再上升时为止;再通入b mL O2,则管内液面又继续上升,测得试管内最后剩余气体为c mL,且该气体不能支持燃烧,这说明剩余气体是NO,则根据方程式4NO2+O2+2H2O=4HNO3、3NO2+H2O=HNO3+2NO可知4b+1.5c=a,B错误;C.已知某温度Ksp(Ag2S)=6×10-50,Ksp(AgCl)=2×10-6,则2AgCl(s)+S2-(aq) Ag2S(s)+2Cl-(aq)的平衡常数=
Ag2S(s)+2Cl-(aq)的平衡常数=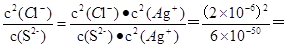 6.7×1037,C错误;D.在25 ℃下,将2a mol·L-1的氨水与0.02 mol·L-1的盐酸等体积混合,反应完全时溶液中c(NH4+)=c(Cl-),则根据电荷守恒可知溶液显中性,溶液中c(NH4+)=c(Cl-)=0.01mol/L,一水合氨的浓度是amol/L—0.01mol/L,因此用含a的代数式表示NH3·H2O的电离常数
6.7×1037,C错误;D.在25 ℃下,将2a mol·L-1的氨水与0.02 mol·L-1的盐酸等体积混合,反应完全时溶液中c(NH4+)=c(Cl-),则根据电荷守恒可知溶液显中性,溶液中c(NH4+)=c(Cl-)=0.01mol/L,一水合氨的浓度是amol/L—0.01mol/L,因此用含a的代数式表示NH3·H2O的电离常数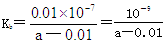 ,D正确,答案选D。
,D正确,答案选D。
考点:考查化学反应计算
本题所属考点:【弱电解质电离平衡】
本题难易程度:【困难】