时间:2016-12-25 23:29:48
选择题 25℃时,向盛有50mL pH=2的HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示。下列叙述正确的是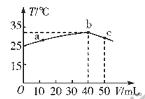
A.HA溶液的物质的量浓度为0.0l mol·L—1
B.b→c的过程中,温度降低的原因是溶液中发生了吸热反应
C.a→b的过程中,混合溶液中可能存 在:c(A-)=c(Na+)
D.25℃时,HA的电离平衡常数K约为1.43×10—2
选择题 25℃时,向盛有50mL pH=2的HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示。下列叙述正确的是
A.H A溶液的物质的量浓度为0.0l mol·L—1
B.b→c的过程中,温度降低的原因是溶液中发生了吸热反应
C.a→b的过程中,混合溶液中可能存在:c(A-)=c(Na+)
D.25℃时,HA的电离平衡常数K约为1.43×10—2
本题答案:C
本题解析:
试题分析:A、当HA溶液和NaOH溶液恰好中和时混合溶液温度最高,即b点,此时消耗氢氧化钠的物质的量为0.004mol,得出HA的浓度为0.08mol/L,错误;B、b→c的过程中,温度降低的原因是加入温度较低的氢氧化钠溶液而使混合液的温度降低,错误;C、根据上述分析知,HA为弱酸,溶液呈酸性,NaA为强碱弱酸盐,溶液呈碱性,a→b的过程中,混合溶液中可能呈中性,存在:c(A-)=c(Na+),正确;D、电离平衡常数K=C(H+)·C(A-)/C(HA)=0.01×0.01÷0.08=1.25×10-3,错误。
考点:考查酸碱混合问题的定性分析和计算。
本题所属考点:【弱电解质电离平衡】
本题难易程度:【一般】