时间:2016-12-25 17:00:36
填空题 (10分)某温度下,水的离子积Kw=l×10-13。有酸溶液A,pH= 91eXAm.orga;碱溶液B,pH=b。为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置。
(1)实验时,烧杯中应盛 (选A或B)溶液。
(2)若A为一元强酸,B为一元强碱,且a+b=13。该同学在烧杯中先加入其中一种溶液,闭合开关K,测得烧杯中灯泡的亮度为10(假设亮度由暗到亮表示为1、2、3、…10、11、12、… 20)。断开开关K,将滴定管中的溶液逐滴加入到烧杯中。当从滴定管滴入烧杯中的溶液体积和烧杯中盛有的溶液体积相等时,停止滴加溶液并闭合开关K,此时灯泡G的亮度约为 ,原因是 。烧杯中得到的溶液pH= 。
(3)若A为强酸,B为强碱,且a+b=13。断开开关K,将滴定管中的溶液逐滴加入到烧杯中。当测得烧杯中溶液pH和“(2)”中最后得到的溶液pH相同时,停止滴加溶液。此时烧杯中的溶液中阳离子浓度大于阴离子浓度,原因可能是 。
(4)若A的化学式为HR,B的化学式为MOH,且a+b=13,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为____ ____。
此时烧杯中的混合溶液中,微粒浓度大小关系一定正确的是___ ___(填序号)。
①c(MOH)>c(M+)>C(R-)>c(H+)>c(OH-)
②c(HR)>c(M+)>c(R-)>c(OH-)>c(H+)
③c(R-)>c(M+)>c(H+)>c(OH-)
④c(M+)>c(R-)>c(OH-)>c(H+)
⑤c(M+)+ c(H+)=c(R-)+c(OH-)
⑥c(MOH)=c(H+)-c(OH-)
填空题 (10分)某温度下,水的离子积Kw=l×10-13。有酸溶液A,pH=a;碱溶液B,pH=b。为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置。
(1)实验时,烧杯中应盛 (选A或B)溶液。
(2)若A为一元强酸,B为一元强碱,且a+b=13。该同学在烧杯中先加入其中一种溶液,闭合开关K,测得烧杯中灯泡的亮度为10(假设亮度由暗到亮表示为1、2、3、…10、11、12、… 20)。断开开关K,将滴定管中的溶液逐滴加入到烧杯中。当从滴定管滴入烧杯中的溶液体积和烧杯中盛有的溶液体积相等时,停止滴加溶液并闭合开关K,此时灯泡G的亮度约为 ,原因是 。烧杯中得到的溶液pH= 。
(3)若A为强酸,B为强碱,且a+b=13。断开开关K,将滴定管中的溶液逐滴加入到烧杯中。当测得烧杯中溶液pH和“(2)”中最后得到的溶液pH相同时,停止滴加溶液。此时烧杯中的溶液中阳离子浓度大于阴离子浓度,原因可能是 。
(4)若A的化学式为HR,B的化学式为MOH,且a+b=13,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为____ ____。
此时烧杯中的混合溶液中,微粒浓度大小关系一定正确的是___ ___(填序号)。
①c(MOH)>c(M+)>C(R-)>c(H+)>c(OH-)
②c(HR)>c(M+)>c(R-)>c(OH-)>c(H+)
③c(R-)>c(M+)>c(H+)>c(OH-)
④c(M+)>c(R-)>c(OH-)>c(H+)
⑤c(M+)+ c(H+)=c(R-)+c(OH-)
⑥c(MOH)=c(H+)-c(OH-)
本题答案:(1)B(2)5 反应后烧杯中自由离子的浓度约为原
本题解析:
试题分析:(1)根据图示中滴定管构造可知,该滴定管为酸式滴定管,则滴定管中盛放的为酸,即A溶液,则烧杯中盛放为碱溶液B,故答案为:B;(2)该温度下,水的离子积Kw=l×10-13,a+b=13的一元强酸和一元强碱等体积混合,溶液呈中性,反应后的溶液为盐溶液,由于体积变成原先的2倍,离子浓度则变为原先的1/2,所以溶液的导电性为5;根据水的离子积可知,该温度下,中性溶液中氢离子浓度为:l×10-6.5mol/L,溶液的pH=6.5,故答案为:5;反应后烧杯中自由离子的浓度约为原溶液的一半;烧杯中得到的溶液pH 为6.5;(3)当溶液呈中性时,有电荷守恒可知,溶液中阳离子所带电荷总浓度应 该等于阴离子所带负电荷总浓度,而现在阳离子浓度大于阴离子浓度,可知1个阴离子所带电荷大于1个阳离子所带电荷,即A为多元强酸,故答案为:A为多元强酸;(4)若A的化学式为HA,B的化学式为BOH,且a+b=13,当从滴定管滴入烧杯中的溶液体积和烧杯中盛有的溶液体积相等时,测得烧杯中溶液pH大于“(2)”中最后得到的溶液pH,说明反应后的溶液显示碱性,则B为弱碱,且反应前溶液中A中c(H+)=B中c(OH-),即反应前c(B)>>c(A),两溶液等体积反应后,B过量;由于B过量,则溶液中c(B+)>c (A-),溶液显示碱性,则c(OH-)>c(H+),反应反应后的溶液中离子浓度大小关系为:c(B+)>c (A-)>c(OH-)>c(H+),A为多元强酸B为弱碱,故该水解反应的离子方程式为; M++H2O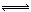 MOH+H+ ; 微粒浓度大小关系一定正确的是 ④⑤
MOH+H+ ; 微粒浓度大小关系一定正确的是 ④⑤
考点:考查了影响溶液导电性因素、强弱电解质的判断
本题所属考点:【盐类水解的原理】
本题难易程度:【困难】